|
1. Основные положения квантовой механики.Согласно принципу, квант дуали3ма поведение объектов микромира может быть описано как движение частицы (корпускулы) и как волновой процесс. Физически это представить невозможно. Математически это описывается уравнением Де Бройля: ƛ=(h*ν)/m*υ, где ν – длина волны, соотв. электрону массой m и движущегося со скоростью υ,h-пост планка де бойля.( Волна де Бройля: p=mV=h/ λme = 9,11·10-31 кг; λ - длина волны де Бройля; h = 6,63·10-34 Дж·с) Гейзенберг сформулировал принцип неопределенности, заключающийся в принципиальной невозможности одновременно точно определить положение микрочастицы в пространстве и ее импульс: Δp*Δx=h/4π. Таким образом, чем точнее определена скорость, тем меньше известно о местоположении частицы, и наоборот. Поэтому для микрочастицы становится неприемлемым понятие траектории движения. Можно лишь говорить о вероятности обнаружить ее в какой-то области пространства. ΔE*Δt=h/4π.(Δp – неопределённость импульса; Δx –неопределённость координат; Δt – неопределённость времени; ΔE – неопределённость энергии) Уравнение Шредингера. Функция ψ – функция, описывающая состояние электрона в атоме или молекуле, часто называется волновой функцией или орбиталью. Ψ2dV – вероятность обнаружения электрона в некотором объеме dV. Ψ2 выражает плотность вероятности нахождения электрона в соответствующей области пространства. Область пространства, где наиболее вероятно нахождение электрона, определяет форму электронного облака. d2 Ψ /dx2+ d2 Ψ /dy2+ d2 Ψ /dz2+8π2m/h2(E-U)=0 Точное решение уравнения есть только для водорода. |
10.
Период. Таблица. Первоначальная формулировка:
свойства простых тел, а также формы и свойства соединений элементов находятся
в периодической зависимости от величины атомных весов элементов. Правило
Менделеева: характеристика элемента – это среднее арифметическое соседних
элементов. В современной формулировке атомная масса заменена на заряд ядра,
соответствующий порядковому номеру элемента. Периодически повторяется
структура внешнего электронного уровня, определяющего свойства элементов.
Энергия ионизации – наименьшая энергия, необходимая для удаления электрона на
бесконечность. Численное значение – потенциал ионизации. Сродство к электрону
– энергия, выделяющаяся или поглощающаяся при присоединении электрона к
нейтральному атому. Определяет окислительную способность частицы. Молекулы с
высокими значениями сродства к электрону – сильные окислители.
Электроотрицательность – способность атома притягивать общую электронную
пару. Электроотрицательность уменьшается справа налево и сверху вниз. Самый
электроотрицательный элемент – F. Справа налево и сверху вниз увеличиваются
металлические и восстановительные свойства. Ра́диус а́тома-
расстояние между атомным ядром и самой дальней из стабильных орбит электронов
в электронной оболочке этого атома. Атомные радиусы при перемещении слева
направо уменьшаются, т.к. электроны все сильнее притягиваются к ядру по мере
возрастания заряда ядра. При перемещении сверху вниз атомные радиусы
элементов растут, потому что заполнено больше электронных уровней. 7
периодов: 1-3 малые; 4-7 большие.Все периоды начинаются щелочными металлами,
а заканчиваются благородными газами.Большие периоды имеют вставные декады
d-элементов.6 и 7 периоды имеют вставки из 14 f-элементов (ланатаноиды и
актиноиды соответственно).С увеличением номера периода увеличивается число
электронных оболочек во внешнем электронном слое.Сходные по свойствам
элементы разных периодов образуют 8 (18) групп: главные; побочные.Все
элементы, в зависимости от занимаемых электронами внешних электронных
оболочек атомов, делятся на: s-элементы; p-элементы; d-элементы;
f-элементы.Периодически изменяется электронное строение атомов химических
элементов.Структура электронных оболочек каждого электронного слоя в атоме
определяется орбитальным квантовым числом l и не зависит от главного
квантового числа n.Z – формальный заряд ядра, номер элемента в периодической
системе элементов.Массовое число A = Np + Nn; Np - число протонов в ядре; Nn
- число нейтронов в ядре. Элемент – совокупность атомов с одинаковым
Z.Изотопы – атомы с одинаковым Z, но разным A.Энергия ионизации Э → Э+
+ ē, ΔH = Eи,1 Э(n-1)+ → Эn+ + ē, ΔH = Eи,n
Способность к окислению в периоде уменьшается.Способность к окислению в
группе увеличивается Энергия сродства к электрону Э + ē → Э-,
ΔH = Ee Способность к восстановлению в периоде увеличивается
Электроотрицательность По Полингу ОЭО (Li)=1; (F)=4 ОЭО в периоде
увеличивается ОЭО в группе уменьшается Знание ОЭО позволяет оценить степень
ионности связи_________________________
22 Равновесие между раствором и осадком. К обменным реакциям,
протекающим в растворе электролитов, относятся реакции осаждения и
растворения. Реакции осаждения - это реакции, идущие с выпадением осадков. В
этих реакциях устанавливается равновесие между кристаллами малорастворимого в
воде сильного электролита и его ионами в растворе. Система, состоящая из
насыщенного раствора и осадка, называется гетерогенной (неоднородной)
системой.В насыщенном растворе малорастворимого в воде сильного электролита
устанавливается равновесие между кристаллами твердого вещества (осадком) и
его ионами, находящимися в растворе. Например, AgCl(тв)=Ag++Cl-В этом случае
идут два противоположных процесса. Ионы серебра и хлорид-ионы, из которых
построены кристаллы хлорида серебра, диполями воды отрывают от поверхности
осадка и переходят в раствор в виде гидратированных ионов, которые
сталкиваются с поверхностью осадка и осаждаются на нем.В соответствии с
законом действующих масс константа равновесия имеет вид
Кsp=[Ag][Cl-]/[AgCl]тв Выражение, отражающее приведенное равновесие, имеет
вид[Ag][Cl-]=ПРAgCl, где [Ag+] и [Cl-] равновесные концентрации
соответствующих ионов в насыщенном растворе, моль/л; ПРAgCl - произведение
растворимости хлорида серебра.Таким образом, произведение растворимости –
произведение молярных концентраций катионов и анионов малорастворимого сильного
электролита в насыщенном растворе при данной температуре. Величина ПР для
каждого малорастворимого соединения постоянна при постоянной температуре и не
зависит от концентрации ионов.В насыщенном растворе малорастворимого
соединения произведение концентраций ионов в растворе равно произведению
растворимости.Для этого же соединения, если произведение концентраций его
ионов в растворе меньше произведения растворимости, раствор не насыщен.
Осадок при этом не образуется. Если произведение концентраций ионов в
растворе будет больше произведения растворимости, из раствора будет выпадать
осадок.ПКИ > Ksp – осадок выпадет ПКИ < Ksp – осадок не
выпадает.Константа растворимости Ksp (или произведение растворимости ПР) -
произведение концентраций ионов в их стехиометрических коэффициентах в
насыщенном растворе малорастворимого электролита - есть величина постоянная и
зависит лишь от температуры. S= корень и3 Ksр,
Кsp=[Ag][Cl-]/[AgCl]тв______________ |
12. Межмолекулярные
взаимодействия (ориентационное, индукционное, дисперсионное) и их природа.
Энергия межмолекулярных взаимодействий. Когда вещество находится в
газообразном состоянии, образующие его частицы хаотически движутся и
преобладающую часть времени находятся на больших (по сравнению со своими
размерами) расстояниях. Вследствие того силы взаимодействия между ними
пренебрежимо малы. В жидком или твердом состоянии расстояния между частицами
малы и силы взаимодействия существенны. Межмолекулярные взаимодействия
обусловлены электромагнитными полями атомных ядер и электронов молекул.
Универсальные взаимодействия проявляются во всех без исключения молекулах.
Эти взаимодействия часто называют силами Ван-дер-Ваальса. Они являются первой
причиной перехода большинства веществ из газообразного состояния в жидкое,
устойчивости молекулярных кристаллов, адсорбции газов поверхностями твердых
тел.Среди сил притяжения выделяют ориентационную, индукционную и
дисперсионную составляющие.Ориентационная составляющая связана с полярностью
молекул. Молекула, обладающая дипольным моментом, притягивает другую полярную
молекулу за счет электростатических сил взаимодействия. Молекулы при этом
стремятся расположиться последовательно или антипараллельно. Такой ориентации
препятствует тепловое движение молекул, поэтому ориентационное взаимодействие
тем больше, чем больше дипольные моменты, меньше расстояние между молекулами
и ниже температура.Индукционная составляющая возникает при взаимодействии
полярной и неполярной молекул. При этом полярная поляризует неполярную, в
которой появляется дипольный момент. В результате возникает притяжение
молекул. Энергия индукционного взаимодействия тем больше, чем больше
дипольный момент полярной молекулы и больше поляризуемость неполярной.
Ориентационные и индукционные силы зависят от наличия полярных молекул,
следовательно не аддитивны.Дисперсионная составляющая универсальна и
присутствует всегда. Наиболее отчетливо это притяжение проявляется при
взаимодействии неполярных молекул и взаимодействии атомов благородных газов.
Суть возникновения заключается в том, что при движении электронов в молекуле
мгновенно появляется асимметрия распределения положительных и отрицательных
зарядов. В результате молекулу можно рассматривать как место возникновения
мгновенно существующих диполей различной направленности. Межмолекулярное
взаимодействие— взаимодействие между электрически нейтральными молекулами
или атомами, не приводящее к разрыву или образованию новых химических связей.
Силы межмолекулярного взаимодействия впервые принял во внимание Я. Д.
Ван-дер-Ваальс (1873) для объяснения свойств реальных газов и жидкостей.Природа
межмолекулярного взаимодействияМежмолекулярное взаимодействие имеет
электрическую природу и складывается из сил притяжения (ориентационных, индукционных
и дисперсионных) и сил отталкивания.Энергия межмолекулярного
взаимодействия:1) Энергия Кеезома- энергия притяжения
двух диполейПритяжение диполь-диполь может осуществляться только тогда, когда
энергия притяжения превышает тепловую энергию молекул; обычно это имеет место
в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в
полярных жидкостях2) Энергия Дебая- энергия притяжения между
постоянным и наведенным диполемПритяжение постоянного и наведенного диполей
обычно очень слабое, поскольку поляризуемость молекул большинства веществ
невелика. Оно действует только на очень малых расстояниях между диполями.
Этот вид взаимодействия проявляется главным образом в растворах полярных
соединений в неполярных растворителях.3) Энергия Лондона—взаимдействия
между неполярными молекуламиЛондоновские силы притяжения между неполярными
частицами (атомами, молекулами) являются весьма короткодействующими. Значения
энергии такого притяжения зависят размеров частиц и числа электронов в
наведенных диполях. Эти связи очень слабые - самые слабые из всех
межмолекулярных взаимодействий. Однако они являются наиболее универсальными,
так как возникают между любыми молекулами. 16 Растворы. При растворении твердого или
газообразного вещества в растворителе при постоянном давлении и температуре (р
= const, Т = const) концентрация раствора не стремится к
бесконечности.Ненасыщенный раствор – это раствор, в котором при
данной температуре вещество ещё может растворяться.В некоторый момент
растворяемое вещество перестает растворяться, т.к. достигнута определенная
его концентрация, которая уже более не меняется и остается
величинойпостоянной,т.е. раствор достиг
фазового равновесия.Насыщенный раствор – раствор, в котором
растворяемое вещество при данной температуре больше не растворяется, т.е.
раствор, находится в равновесии с растворяемым веществом.При изменении
температуры или давления можно продлить процесс растворения. При этом получим
раствор, содержащий растворенного вещества больше, чем его должно быть в
обычных условиях в насыщенном растворе. Такой раствор называется пересыщенным.
Пересыщенные растворы – это неустойчивые, неравновесные системы, которые,
например, при лёгком сотрясении сосуда или введении в раствор кристаллов
вещества, находящегося в растворе, переходят в равновесное состояние, выделяя
избыток растворенного вещества, и раствор становится насыщенным.Насыщенные
растворы в зависимости от значения растворимости веществ
разделяются на:концентрированные, в которых массы растворённого вещества и
растворителя сравнимы между собой;разбавленные, в которых масса растворённого
вещества в несколько раз меньше, чем масса растворителя.
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная
отношению массы растворённого вещества к общей массе раствора. Молярная
концентрация C(B) показывает, сколько моль растворённого вещества содержится
в 1 литре раствора 19.Растворы слабых электролитов. Электролиты –
вещества, которые в растворе или расплаве состоят полностью или частично из
ионов.Исходя из степени диссоциации все электролиты делятся на 3 группы: 1.
Сильные электролиты – электролиты, степень диссоциации близка к 1. К ним
относятся например HCl, H2SO4, HNO3, NaOH, KOH, NaCl 2. Средние электролиты –
электролиты, диссоциирующие частично (от 0,03 до 0,3). H3PO4, Mg(OH)2. 3.
Слабые электролиты практически не диссоциируют. К ним относятся плохо
растворимые соли, большинство органических кислот, H2S, Cu(OH)2. Для оценки
полноты диссоциации в теории электролитической диссоциации вводится понятие
степени диссоциации, которая равна отношению числа молекул, распавшихся на
ионы, к общему числу молекул. α= N/N0. Факторы, влияющие на ст
ионизации:-природа р-ра (тип хим связи, полярность, поляризуемость),природа
растворителя(сольватирующая способность, диэлектрическая проницаемость),
концентрация р-ра (чем ниже С, тем выше α). Слабые электролиты:Процесс
ионизации обратим, Многоосновные ионизируют ступенчато, Т.к ионизация
обратима, то применим закон д-я масс СН3СООН ↔ Н+ + СН3СОO- Ka=[ Н+][
СН3СОO-]/[ СН3СООН] Многоступенчато:HgBr42- = HgBr3-+Br - K4H=[ HgBr3- ]*[ Br
-]/ [HgBr42-];HgBr3- = HgBr2 + Br - K3H=[ HgBr2]*[ Br -]/[HgBr3-]];HgBr + =
Hg2+ + Br - K1H =[ Hg2+]*[ Br -]/[ HgBr +]/ Константа ионизации показывает
отношение частиц, диссоциирующих в раствор, к количеству
непродиссоциировавшего вещества. Зависит от: природы в-ва и от температуры.
Равновесие в растворах электролитов, как и всякое химическое равновесие,
сохраняется неизменным, пока определяющие его условия не меняются.Но
равновесие нарушается при изменении концентрации одного из участвующих в этом
равновесии ионов: при ее увеличении происходит процесс, в ходе которого эти
ионы связываются/введение в раствор слабого электролита одноименных ионов (т.
е. ионов, одинаковых с одним из ионов электролита) уменьшает степень
диссоциации этого электролита. уменьшение концентрации одного из ионов
вызывает диссоциацию нового количества молекул._____________ |
|
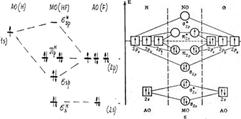
2.Многоэлектронные атомы. Квантовые числа – это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Главное квантовое число (n): характеризует энергию электрона в атоме, размер атома. В периодической системе число соответствует номеру периода. Принимает значения 1,2,3… Орбитальное (побочное) квантовое число (l): l=0,1,2,3…(n-1) n=1: l=0; n=2: l=0,1; n=3: l=0,1,2. Характеризует подуровень. Характеризует момент импульса и определяет форму электронного облака. l=0 – s (сфера); l=1 – p (гантель); l=2 – d; l=3 – f; l=4 – g; l=5 – h. Магнитное квантовое число (m) m= -l…-1,0,1…l. n=1 l=0 m=0; n=2 l=0,1 m=-1,0,1; n=3 l=0,1,2 m=-2,-1,0,1,2 Определяет возможные ориентации электронного облака в пространстве. Характеризует проекцию момента количества движения. Спиновое квантовое число (ms): отражает наличие у электрона собственного момента движения. Проекция собственного момента движения на избранное направление называется спином. Принимает значения ±1/2. При записи формул и составлении энергетических диаграмм, отражающих состояние электронов в атомах и молекулах, наличие того или иного значения спинового квантового числа указывают стрелкой ↑ или ↓.Орбитальное квантовое число и форма электронного облака:(L – 0; 1; 2; 3 АО – s; p; d; f)Многоэлектронные атомы: Многоэлектронные атомы имеют 2 и более электронов. Уравнение Шредингера решается приближённо. Электроны занимают различные АО и образуют электронные слои в зависимости от главного квантового числа (n- 1; 2;3;4;5;6;7Слой- K; L; M; N; O; P; Q)Каждый электронный слой состоит из электронных оболочек(Слой- K(n = 1); L(n = 2); M(n = 3); N(n = 4)Оболочки- s; s, p; s, p, d; s, p, d, f)Каждая электронная оболочка состоит из квантовых ячеек – орбиталей, в зависимости отчисла магнитных квантовых чисел ml.(Оболочка – s; p; d; fЧисло АО - 1;3;5;7)Состояние электрона в многоэлектронном атоме. Чем больше n, тем больше энергия электрона (больше размер электронного облака,меньше прочность связи его с ядром). Чем больше l (при одинаковых n), тем больше энергия электрона. Электрон, кроме электрического заряда, обладает магнитными свойствами, которые характеризуются спиновым квантовым числом ms, введённым Дираком. Электроны с одинаковыми ms (с параллельными спинами) отталкиваются, а с противоположными ms (антипараллельными спинами) – притягиваются. Взаимодействие электронов с параллельными и антипараллелными спинами: С параллельными спинами – отталкивание; с антипараллельными – притяжение.Принцип наименьшей энергии: в первую очередь заполняются уровни с наименьшей энергией.Принцип запрета (принцип Паули): в атоме не могут находиться 2 электрона с одинаковым набором квантовых чисел. Так как одной атомной орбитали соответствует фиксированное значение 3 квантовых чисел (n,l,m), то на ней может располагаться только 2 электрона с противоположными спинами (такие электроны называются спаренными).Правило Клечковского: в первую очередь формируются подуровни с наименьшей энергией, т.е. имеющие наименьшую сумму n+l. Если они равны, то там, где меньше значение n.Правило Хунда: в наиболее устойчивом состоянии атома электроны размещаются в пределах орбитали подуровня так, чтобы их суммарный спин был максимален. Правило не запрещает другого распределения электронов в пределах подуровня. Состояние атома с меньшим суммарным спином будет энергетически менее выгодно и будет относиться к возбужденному состоянию. |
||
|
3
Теория молекулярных орбиталей (МО) дает представление о распределении
электронной плотности и объясняет свойства молекул. В этой теории квантовомеханические
зависимости дляатомараспространены на более сложную систему — молекулу.
Молекула рассматривается как целое, а не как совокупность сохранивших
индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные
энергетические состояния отдельныхэлектронов(молекулярные орбитали) с их
самосогласованным движением в поле друг друга и всех ядер молекулы.Понятие
о несвязывающей МО:В Результате притяжения каждого атомного ядра в
направлении к межъядерной области пространства окажется более слабым, чем в
противоположном направлении, т.е. возникнут силы, приводящие к взаимному
отталкиванию ядер. Здесь химическая связь не возникает; образовавшаяся в этом
случае МО называется разрыхляющей, а находящиеся на ней электроны -
разрыхляющими электронами. |
||
|
4.Основные положения ММО. Основные положения: Каждый электрон находится электрическом поле ядер всех атомов и других электронов. Волновая функция, описывающая состояние электрона в молекуле, называется молекулярной орбиталью (МО). Каждая МО является линейной комбинацией АО (ЛКАО), то есть ΨМО = c1ΨАО,1 + c2ΨАО,2 + c3ΨАО,3 + … c1, c2, c3 и т.д. – коэффициенты, принимающие любые значения от -1 до +1. Количества МО и АО равны. Порядок заполнения МО:Принцип наименьшей энергии,Правило Хунда,Принцип Паули. ΨМО = c1ΨА + c2ΨB – связывающая МО Ψ*МО = c3ΨА – c4ΨB – разрыхляющая МО ΨМО|2 = c12ΨА2 + c22 ΨB2 + 2c1c2ΨАΨB |Ψ*МО|2 = c32ΨА2 + c42ΨB2 - 2c3c4ΨАΨB (c12ΨА2, c32ΨА2 – вероятность нахождения электрона вблизи ядра атома A;c22 ΨB2, c42ΨB2 - вероятность нахождения электрона вблизи ядра атома B;2c1c2ΨАΨB, 2c3c4ΨАΨB – вероятность нахождения электрона между ядрами атомов.)1. Энергия электронов на связывающей МО ΨМО (σ-МО) ниже, чем на АО изолированных атомов водорода.2. Энергия электронов на разрыхляющей МО Ψ*МО (σ*-МО) выше, чем на АО изолированных атомов водорода. Кратность связи ММО:ƞ=1/2(Nсв- Nразр) Nсвяз – число электронов на связывающих орбиталях Nразр – число электронов на разрыхляющих орбиталях Если Nсвяз > Nразр, связь образуется. Если Nсвяз ≤ Nразр, связь не образуется. Чем больше n, тем прочнее (энергия связи больше) и короче связь.Условия устойчивости: в наиболее устойчивом состоянии (невозбужденном) атома электроны занимают атомные орбитали, характеризующиеся наименьшей возможной энергией. Точно так же наиболее устойчивое состояние молекулы достигается в том случае, когда электроны занимают МО, отвечающие минимальной энергии. |
||
|
|
||
|
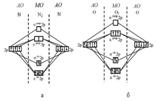
6. МВС. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга. В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей.Основные положения теории следующие:1. Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.2. Число гибридных орбиталей равно числу АО, участвующих в гибридизации.3. Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.4. В гибридизации участвуют АО, имеющие общие признаки симметрии. гибридные орбитали дают молекулы с углами 180°, 120°, 109°28", 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими илинеподеленными электронными парами.sр линейная(180), sр2 плоск. Треугольная 120, sр3 тетраэдр 109, sр2d квадрат 90, sр3d или dsр3 тригонально-бипирамидальная 90,120, d2sр3 или sр3d2 октаэдр 90. |
||
|
7,Квант числа,см 2. Совокупность состояний электрона в атоме с одним и тем же значением n называют энергетическим уровнем. Число уровней, на которых находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент. Номера этих уровней обозначают цифрами: 1, 2, 3,... (реже - буквами K, L, M, ...).Энергетический подуровень - совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначают буквами: s, p, d, f... Первый энергетический уровень имеет один подуровень, второй - два подуровня, третий - три подуровня и так далее. ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь). s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат. На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность. |
||
|
8, Осн типы хим связи. Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла. В зависимости от типов атомов, образующих химическую связь, выделяют и типы химической связи: ковалентную, ионную, металлическую и др. Образование химической связи – экзотермический процесс.Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.Предельным случаем ковалентной полярной является ионная связь. Ионная связь в чистом виде не существует, так как в любой химической связи всегда имеется та или иная доля ковалентного характера. Связь такого типа упрощенно считается осуществляемой в результате взаимодействия электростатического притяжения противоположно заряженных ионов. Предполагается, что при образовании ионной связи атомы стремятся отдать или приобрести столько электронов, чтобы строение их внешнего электронного уровня оказалось аналогичным строению устойчивого внешнего уровня ближайшего по расположению благородного газа. Ионная связь не обладает насыщаемостью и направленностью.Металлическая связь – химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решетку, с электронным газом из валентных электронов. В узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, удерживающие вместе положительные ионы.Водородная связь: катион водорода осуществляет дополнительную связь с наиболее электроотрицательными элементами (фтор, кислород, азот). |
||
|
9. Тепловой
эффект. Термодинамика изучает переходы энергии из одной формы в другую, от
одной части системы к другой в различных процессах; пределы самопроизвольного
течения процессов в данных условиях.Химическая термодинамика изучает
зависимости термодинамических свойств веществ от их состава, строения,
условий существования, термодинамические явления из области химии.
Термодинамические процессы Химические реакции Фазовые переходы: -плавление
(кристаллизация) -испарение (конденсация) Растворение, Самопроизвольные, не
самопроизвольные, Обратимые, Необратимые, Круговые. Второй закон
термодинамики. Первый закон термодинамики позволяет определить тепловой
эффект химической реакции или других термодинамических процессов, но не
отвечает на вопрос о направлении самопроизвольного протекания процесса.
Второй закон термодинамики отвечает на этот вопрос в случае изолированных
термодинамических систем: Любой реальный самопроизвольный процесс является
необратимым.Естественные процессы всегда направлены в сторону достижения
системой равновесного состояния (механического, термического или любого
другого). Это явление и отражено вторым законом термодинамики. В соответствии
с этим законом, например, теплота самопроизвольно может переходить только от
тела с большей температурой к телу с меньшей температурой. Для осуществления
обратного процесса должна быть затрачена определенная работа. В связи с этим
второй закон термодинамики можно сформулировать следующим образом: невозможен
процесс, при котором теплота переходила бы самопроизвольно от тел более
холодных к телам более тёплым (постулат Клаузиуса, 1850 г.). Второй закон
термодинамики например для экзотермических реакций означает, что не весь
тепловой эффект этой реакции может быть превращён в полезную работу. Часть
выделившейся тепловой энергии должна быть отведена от зоны реакции, чтобы не
происходило её перегревания. В случае эндотермических реакций необходимо
подводить тепло к зоне реакции, чтобы данная реакция не замедлялась
вследствие охлаждения реакционной смеси.Математическая форма второго закона
термодинамики для 1 моль вещества: (1) или Q ≤ TΔS (2) S1 -
молярная энтропия системы в исходном состоянии, S2 - молярная энтропия
системы в конечном состоянии, Q - количество тепла, поступившего в систему
(или отданного системой), T - абсолютная температура системы.Энтропия служит
мерой неупорядоченности термодинамической системы. Чем больше энтропия
системы, тем более хаотично (неупорядоченно) движутся образующие её частицы.
Из выражений (1) и (2) следует, что знаки ΔS и Q совпадают (температура
всегда положительна). Если тепло поступает в систему (Q > 0), то и её
энтропия возрастает (ΔS > 0 или S2 > S1). И наоборот, при
отведении тепла из системы (Q < 0) уменьшается и её энтропия (ΔS <
0 или S2 |
Шпоры по квантовой механике1. Основные положения квантовой механики.
2. Многоэлектронные атомы. Квантовые числа 4. Теория молекулярных орбиталей 5. Основные положения ММО и другие | |
|
Текст: |














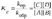 Отношение констант
скоростей прямой и обратной реакций ( kпр/kобр) называют
константой химического равновесия. Если система находится в равновесии, то
она будет пребывать в нем до тех пор, пока внешние условия сохраняются
постоянными. Процесс изменения каких-либо условий, влияющих на равновесие,
называется смещением равновесия.Принцип Ле: Если на сист. наход. в равновесии
оказать внешнее воздействие, то система измен. таким образом, чтобы
компенсировать это воздействие.Следствия: 1) При увеличении температ.
равновесие смещ. в пользу эндотермической реакции.2) При увеличении давления
равновесие смещ. в сторону меньшего объёма(или меньш. числа молей)3) При
увеличении концентрации одного из исходных веществ равновесие смещается в
сторону увеличения концентрации продуктов реакции, и наоборот.__________________________________________
Отношение констант
скоростей прямой и обратной реакций ( kпр/kобр) называют
константой химического равновесия. Если система находится в равновесии, то
она будет пребывать в нем до тех пор, пока внешние условия сохраняются
постоянными. Процесс изменения каких-либо условий, влияющих на равновесие,
называется смещением равновесия.Принцип Ле: Если на сист. наход. в равновесии
оказать внешнее воздействие, то система измен. таким образом, чтобы
компенсировать это воздействие.Следствия: 1) При увеличении температ.
равновесие смещ. в пользу эндотермической реакции.2) При увеличении давления
равновесие смещ. в сторону меньшего объёма(или меньш. числа молей)3) При
увеличении концентрации одного из исходных веществ равновесие смещается в
сторону увеличения концентрации продуктов реакции, и наоборот.__________________________________________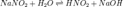
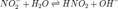 Уравнение
константы равновесия для данной реакции будет иметь вид:
Уравнение
константы равновесия для данной реакции будет иметь вид: или
или  Так
как концентрация молекул воды в растворе постоянна, то произведение двух
постоянных
Так
как концентрация молекул воды в растворе постоянна, то произведение двух
постоянных  можно
заменить одной новой — константой гидролиза:
можно
заменить одной новой — константой гидролиза: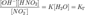 Численное
значение константы гидролиза получим, используя ионное произведение
воды
Численное
значение константы гидролиза получим, используя ионное произведение
воды 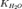 и
константу диссоциации азотистой кислоты
и
константу диссоциации азотистой кислоты 

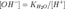 подставим
в уравнение константы гидролиза равна:
подставим
в уравнение константы гидролиза равна: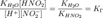 В
общем случае для соли, образованной слабой кислотой и сильным основанием:
В
общем случае для соли, образованной слабой кислотой и сильным основанием: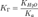 ,
где Ka — константа диссоциации слабой кислоты, образующейся
при гидролизе.для соли, образованной сильной кислотой и слабым основанием:
,
где Ka — константа диссоциации слабой кислоты, образующейся
при гидролизе.для соли, образованной сильной кислотой и слабым основанием: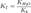 ,
где Kb — константа диссоциации слабого основания,
образующегося при гидролизе для соли, образованной слабой кислотой и слабым
основанием:
,
где Kb — константа диссоциации слабого основания,
образующегося при гидролизе для соли, образованной слабой кислотой и слабым
основанием: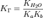 .
Факторы, влияющие на степень гидролиза:С увеличением Ka (Kb) степень
гидролиза соли уменьшается,С увеличением концентрации соли в растворе степень
гидролиза соли уменьшается,С увеличением температуры степень гидролиза соли
увеличивается (увеличивается Kw) Добавки кислот,Добавки щелочей,Добавки
солей________________________
.
Факторы, влияющие на степень гидролиза:С увеличением Ka (Kb) степень
гидролиза соли уменьшается,С увеличением концентрации соли в растворе степень
гидролиза соли уменьшается,С увеличением температуры степень гидролиза соли
увеличивается (увеличивается Kw) Добавки кислот,Добавки щелочей,Добавки
солей________________________