МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РФ
СЕВЕРНЫЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ
Факультет повышения квалификации и профессиональной переподготовки специалистов
Кафедра терапии, эндокринологии и СМП
РЕФЕРАТ
на тему:
«Современная терапия ревматоидного артрита»
Выполнил:
Курсант
Костиневич Александр Михайлович
Руководитель:
Архангельск – 2016
СОДЕРЖАНИЕ.
1. Введение стр. 2-3
2.Основная часть стр. 4-19
3. Заключение стр. 19
4. Список литературы стр. 20
ВВЕДЕНИЕ.
Ревматоидный артрит — это заболевание, которому уделяют самое пристальное внимание ревматологи всего мира в течение десятилетий. Он занимает центральное место среди воспалительных заболеваний суставов. Это связано с большим медицинским и социальным значением этой болезни. Его распространенность достигает по разным данным от 0,5% до 2% от общей численности населения в промышленно развитых странах. У больных ревматоидным артритом наблюдается уменьшение продолжительности жизни по сравнению с общей популяцией на 3–7 лет за счёт потенциально опасных системных проявлений и осложнений (васкулит, амилоидоз и др.). К настоящему времени во многих исследованиях доказано, что выживаемость больных РА значительно ниже, в сравнении с общей популяцией, а уровень смертности в 1,5-1,6 раза выше и ведущей причиной таких последствий являются кардиоваскулярные заболевания. Согласно официальной статистике в 2005 г. в РФ было зарегистрировано более 250 000 больных страдающих подтверждённым РА. Женщины болеют РА примерно в три раза чаще мужчин. Для РА, особенно для дебюта заболевания, характерен выраженный полиморфизм проявлений и совершенно непредсказуемый прогноз.
Трудно переоценить колоссальный ущерб, наносимый этим заболеванием обществу за счет ранней инвалидизации пациентов. Она, при отсутствии своевременно начатой активной терапии, может наступать в первые 5 лет от дебюта болезни.
Ревматоидный артрит — хроническое неуклонно прогрессирующее воспалительное заболевание неясной этиологии, для которого характерны: хронический эрозивный артрит (синовит) и дегенеративное воспаление периартикулярных тканей, сопровождающееся аутоиммунными нарушениями и, способное приводить к деструкции суставного хряща и кости, а также к системным воспалительным изменениям. Кроме того, часто встречается системное воспалительное поражение внутренних органов, выступающие иногда на первый план, определяя прогноз и исходы заболевания. Многие клиницисты называют РА «ревматоидной болезнью», подчёркивая тем самым системный характер патологического процесса. РА с системными проявлениями – это высокоактивная, генерализованная форма болезни, встречающаяся главным образом у серопозитивных больных.
Характерное поражение суставов кисти с типичной симметричностью, полиартрит с почти обязательным вовлечением лучезапястных, пястнофаланговых и проксимальных межфаланговых суставов 2 и 3-го пальцев на протяжении не менее 6 нед., наличие утренней скованности более 1 ч., имеют большое значение для диагностики. Течение болезни осложняется наличием подкожных (ревматоидных) узлов, чаще всего локализующихся на разгибательной поверхности вблизи локтевых суставов, а также выявление ревматоидного фактора (РФ) и антител к циклическому цитруллированному пептиду (анти-ЦЦП).
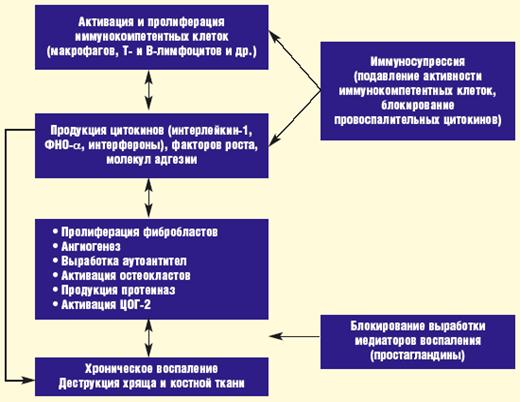
Патогенез заболевания весьма сложен и во многом недостаточно изучен. Несмотря на это, к настоящему времени хорошо известны некоторые ключевые моменты в развитии ревматоидного воспаления, которые определяют основные методы лечебного воздействия на него. Развитие хронического воспаления в данном случае связано с активацией и пролиферацией иммунокомпетентных клеток (макрофагов, Т - и В-лимфоцитов), что сопровождается выделением клеточных медиаторов - цитокинов, факторов роста, молекул адгезии, а также синтезом аутоантител (например, антицитруллиновых антител) и формированием иммунных комплексов (ревматоидные факторы). Эти процессы ведут к формированию новых капиллярных сосудов (ангиогенез) и разрастанию соединительной ткани в синовиальной оболочке, к активации циклооксигеназы-2 (ЦОГ-2) с повышением синтеза простагландинов и развитием воспалительной реакции, к выделению протеолитических ферментов, активации остеокластов, а в результате к деструкции нормальных тканей суставов и возникновению деформаций.
Рисунок 1. Ключевые моменты в развитии ревматоидного воспаления.
ЛЕЧЕНИЕ РЕВМАТОИДНОГО АРТРИТА.
Своевременная ранняя диагностика РА приоткрывает «окно возможности», т.е. ограниченный период времени, в течение которого лечение хронического заболевания более эффективно (возможность) по сравнению с любым другим периодом болезни. Для постановки дифференцированного диагноза РА и назначения адекватной терапии выделены факторы быстрого прогрессирования структурных изменений или факторы риска неблагоприятного прогноза.
К ним относятся:
-вовлечение в патологический процесс многих суставов,
-наличие внесуставных проявлений,
-серопозитивность по ревматоидному фактору и антителам к циклическому
цитруллированному пептиду (анти-ЦЦП) в дебюте болезни,
-высокая воспалительная активность, увеличение СОЭ и СРБ,
-обнаружение определенных аллелей HLA-DR (0101, 0401, 0404/0408, 1402),
-выявление эрозий в суставах в дебюте болезни,
-молодой или пожилой возраст начала болезни,
- плохие социально-экономические условия жизни.
Определенное значение имеет также постепенное начало заболевания, раннее поражение крупных суставов, персистирующая активность при отсутствии ремиссий в течение 1 года, носительство DR4/Dw4. Целью терапии РА является достижение ремиссии или даже излечения, что стало возможно с введением ГИБТ (генно-инженерных биологических препаратов). ГИБП радикально улучшили результаты лечения ранее некурабельных больных. После внедрения ГИБП в клиническую практику помимо купирования симптомов заболевания в настоящее время ставятся такие задачи, как торможение эрозивного процесса в суставах, нормализация функционального статуса и качества жизни больного, потенциальное увеличение продолжительности жизни до популяционного уровня.
Лечение включает:
-медикаментозную терапию;
-немедикаментозные методы терапии;
-ортопедическое лечение, реабилитацию.
Исходя из патогенеза заболевания, становится очевидным, что эффективно воздействовать на развитие заболевания можно на двух уровнях:
-подавляя избыточную активность иммунной системы;
-блокируя выработку медиаторов воспаления, в первую очередь
простагландинов.
Основными целями лечения при РА являются:
-купирование симптомов заболевания,
-достижение клинической ремиссии или, как минимум, низкой активности
болезни;
-торможение прогрессирования структурных изменений в суставах и
соответствующих функциональных нарушений;
-улучшение качества жизни больных, сохранение трудоспособности.
Основной задачей такого лечения является подавление симптомов артрита и внесуставных проявлений, предотвращение деструкции, нарушений функции и деформации суставов, сохранение (улучшение) качества жизни, увеличение продолжительности жизни (до популяционного уровня). Для ремиссии РА характерны длительность утренней скованности не более 15 мин, отсутствие утомляемости, болей в суставах и болезненности суставов при пальпации, отсутствие припухлости мягких тканей в области суставов или сухожилий, СОЭ на субнормальном или нормальном уровне (не более 20 мм/ч для женщин и 15 мм/ч для мужчин). Современная парадигма предусматривает активную (агрессивную) терапию РА с самого начала заболевания.
Это обусловлено ранним и необратимым развитием рентгенологических изменений в суставах при давности заболевания, не превышающей 1-2 года, и даже в первые 3 мес. клинической презентации болезни; ранним и необратимым нарушением функциональной активности, хорошей переносимостью и безопасностью основных БПВП, высокой эффективностью ГИБП. Для лечения РА применяют симптоматические противовоспалительные препараты и препараты, контролирующие болезнь.
Системная медикаментозная терапия включает применение четырёх групп препаратов:
1. нестероидные противовоспалительные препараты (НПВП),
2. базисные препараты,
3. глюкокортикостероиды (ГКС),
4. биологические агенты.
Для лечения РА применяют симптоматические противовоспалительные препараты и препараты, контролирующие болезнь.
К первым относятся симптоматические быстродействующие средства (нестероидные противовоспалительные (НПВП) и глюкокортикоиды) и симптоматические медленнодействующие средства (аминохинолиновые производные, цитостатики и соли золота). Препараты этой группы уменьшают интенсивность боли в суставах, длительность и выраженность утренней скованности, а также улучшают функциональную способность опорно-двигательного аппарата, но, как правило, не влияют на темпы прогрессирования структурных изменений. Что касается медленнодействующих симптоматических препаратов, то они также уменьшают выраженность симптомов заболевания вплоть до их полного купирования, влияют на течение заболевания и возможный исход. Препараты второй группы, способные контролировать болезнь, не только улучшают функцию пораженных суставов, но и замедляют прогрессирование РА.
К ним относятся БПВП и ГИБП. Центральное место среди симптом-модифицирующих препаратов при лечении РА занимают НПВП. Они являются препаратами выбора для стартовой терапии артритов. НПВП активно уменьшают интенсивность боли в суставах, длительность и выраженность утренней скованности, а также улучшают функциональную способность опорно-двигательного аппарата. В то же время НПВП при РА сдерживают гиперплазию синовиоцитов – клеток, занимающих одно из ведущих положений в патологии этого заболевания, и в связи с этим их можно рассматривать не только как симптоматические, но и, в какой-то степени, патогенетические средства.
Существенно снизить нежелательные явления, возникающие при приеме НПВП, стало возможно с появлением препаратов, преимущественно воздействующих на одну из изоформ ЦОГ – ЦОГ-2, являющихся производными эноликоновой кислоты. Анализ большого числа исследований показал, что мелоксикам по сравнению с традиционными НПВП (диклофенаком, пироксикамом и напроксеном) снижает риск отмены препарата из-за развития желудочно-кишечных осложнений на 41%, риск развития серьезных побочных реакций (перфорации, изъязвления, кровотечения) – на 48% и риск кишечных диспепсий – на 27%. Мелоксикам по сравнению с традиционными НПВП обладает более благоприятным профилем не только желудочно-кишечной безопасности, но и гепато - и нефротоксичности.
По-прежнему актуальна терапия глюкокортикоидами, хотя перед её назначением, следует взвесить все за и против, чтобы избежать в дальнейшем развития стероидой болезни или проявлений синдрома отмены. При проведении терапии глюкокортикоидами обычно применяют, возможно, низкую дозу, приводящую к положительному эффекту. Начальная доза не должна превышать 20 мг/сут. (в пересчете на преднизолон), а длительная терапия предусматривает назначение не более 7,5–10 мг/сут, при этом следует помнить, что назначение низких доз (преднизолон <10 мг/сут) позволяет эффективно контролировать клинические проявления суставного синдрома. При проведении глюкокортикоидной терапии следует не только проводить тщательный мониторинг, что обусловлено широким спектром нежелательных явлений такой терапии, но и учитывать возможное взаимодействие с другими препаратами.
При раннем РА лечение ГК (в сочетании с БПВП) ассоциируется с более выраженным клиническим улучшением в плане замедления прогрессирования деструкции суставов, чем монотерапия БПВП, и такой эффект сохраняется после завершения приема глюкокортикоидов. Показанием к назначению сте-роидной терапии при РА являются: генерализованный артрит с выраженным экссудативным компонентом, торпидный к терапии НПВП и локальным глю-кокортикоидам, высокая воспалительная активность до начала действия БПВП (bridge-терапия), неэффективность НПВП и БПВП, максимальная активность воспалительного процесса, системные проявления заболевания (подкожные узлы, синдром Стилла и Фелти), другие проявления ревматоидного васкулита, нежелательные явления проводимой терапии БПВП (например, фиброзирующий альвеолит).
Поскольку, помимо собственно воспаления, активация иммунной системы сопровождается многими другими патологическими процессами, воздействие на первом уровне является существенно более глубоким и эффективным, нежели на втором. Медикаментозная иммуносупрессия представляет собой основу лечения ревматоидного артрита. К иммуносупрессорам, применяющимся для лечения данного заболевания, относятся базисные противовоспалительные препараты (БПВП), биологические препараты и глюкокортикостероиды. На втором уровне действуют нестероидные противовоспалительные препараты (НПВП) и глюкокортикостероиды.
В целом иммуносупрессивная терапия сопровождается более медленным развитием клинического эффекта (в широких рамках — от нескольких дней в случае биологической терапии до нескольких месяцев в случае применения некоторых БПВП), который в то же время бывает очень выраженным (вплоть до развития клинической ремиссии) и стойким, а также характеризуется торможением деструкции суставов.
Собственно, противовоспалительная терапия (НПВП) может давать клинический эффект (обезболивание, уменьшение скованности) очень быстро в течение 1–2 ч, однако при помощи такого лечения практически невозможно полностью купировать симптоматику при активном ревматоидном артрите и, по-видимому, оно совсем не влияет на развитие деструктивных процессов в тканях.
Глюкокортикостероиды обладают как иммуносупрессивным, так и непосредственным противовоспалительным эффектом, поэтому клиническое улучшение может развиваться быстро (в течение нескольких часов при внутривенном или внутрисуставном введении). Имеются данные о подавлении прогрессирования эрозивного процесса в суставах при длительной терапии низкими дозами глюкокортикостероидов и о положительном их влиянии на функциональный статус больного. В то же время из практики хорошо известно, что назначение только глюкокортикостероидов, без других иммуносупрессивных средств (БПВП), редко дает возможность достаточно эффективно контролировать течение болезни.
Немедикаментозные способы терапии ревматоидного артрита (физиотерапия, бальнеотерапия, диетотерапия, акупунктура и др.) представляют собой дополнительные методики, с помощью которых можно несколько улучшить самочувствие и функциональный статус пациента, но не купировать симптоматику и достоверно повлиять на деструкцию суставов.
Ортопедическое лечение, включающее ортезирование и хирургическую коррекцию деформаций суставов, а также реабилитационные мероприятия (лечебная физкультура и др.) имеют особое значение преимущественно на поздних стадиях заболевания для поддержания функциональной способности и улучшения качества жизни больного.
Надо иметь в виду, что цели лечения могут существенно изменяться в зависимости от длительности болезни. На ранней стадии болезни, т. е. при длительности болезни 6–12 мес., достижение клинической ремиссии — вполне реальная задача, так же, как и торможение развития эрозий в суставах. С помощью современных методов активной медикаментозной терапии удается добиться ремиссии у 40–50% пациентов, показано также отсутствие появления новых эрозий по данным рентгенографии и магнитно-резонансной томографии у значительного количества больных при длительности наблюдения 1–2 года.
При длительно текущем ревматоидном артрите, особенно при недостаточно активной терапии в первые годы заболевания, достижение полной ремиссии теоретически тоже возможно, однако вероятность этого значительно ниже. То же самое можно сказать и о возможности остановить прогрессирование деструкции в суставах, уже существенно разрушенных за несколько лет болезни. Поэтому при далеко зашедшем ревматоидном артрите возрастает роль реабилитационных мероприятий, ортопедической хирургии. Кроме того, на поздних стадиях заболевания длительная поддерживающая базисная терапия может использоваться для вторичной профилактики осложнений болезни, таких как системные проявления (васкулит и др.), вторичный амилоидоз.
БАЗИСНАЯ ТЕРАПИЯ РЕВМАТОИДНОГО АРТРИТА.
БПВП (синонимы: базисные препараты, болезнь-модифицирующие антиревматические препараты, медленно действующие препараты) являются главным компонентом лечения ревматоидного артрита и при отсутствии противопоказаний должны быть назначены каждому пациенту с этим диагнозом. Особенно важно максимально быстрое назначение БПВП (сразу после установления диагноза) на ранней стадии, когда имеется ограниченный период времени (несколько месяцев от появления симптоматики) для достижения наилучших отдаленных результатов — так называемое «терапевтическое окно».
Классические БПВП обладают следующими свойствами.
- Способность подавлять активность и пролиферацию иммунокомпетентных клеток (иммуносупрессия), а также пролиферацию синовиоцитов и фибробластов, что сопровождается выраженным снижением клинико-лабораторной активности РА.
- Стойкость клинического эффекта, в том числе его сохранение после отмены препарата.
- Способность задерживать развитие эрозивного процесса в суставах.
-Способность индуцировать клиническую ремиссию.
- Медленное развитие клинически значимого эффекта (обычно в течение 1–3 мес. от начала лечения).
БПВП существенно различаются между собой по механизму действия и
особенностям применения.
БПВП условно могут быть подразделены на препараты первого и второго ряда.
Препараты первого ряда обладают наилучшим соотношением эффективности (достоверно подавляют как клиническую симптоматику, так и прогрессирование эрозивного процесса в суставах) и переносимости, в связи, с чем назначаются большинству пациентов.
К БПВП первого ряда относятся следующие:
-Метотрексат — «золотой стандарт» терапии ревматоидного артрита. Рекомендуемые дозы — 7,5–25 мг в неделю — подбираются индивидуально путем постепенного повышения на 2,5 мг каждые 2–4 нед. до достижения хорошего клинического ответа либо возникновения непереносимости. Препарат дается внутрь (еженедельно в течение двух последовательных дней дробно в 3–4 приема каждые 12 ч). В случае неудовлетворительной переносимости метотрексата при приеме внутрь за счет диспепсии и других жалоб, связанных с желудочно-кишечным трактом (ЖКТ), препарат может быть назначен парентерально (одна в/м или в/в инъекция в неделю).
-Лефлуномид (арава). Стандартная схема лечения: внутрь по 100 мг в сутки в течение 3 дней, затем 20 мг/сут. постоянно. При риске непереносимости препарата (пожилой возраст, заболевания печени и др.) лечение можно начинать с дозы 20 мг/сут. По эффективности сопоставим с метотрексатом, имеет несколько лучшую переносимость. Есть данные о более высокой эффективности лефлуномида в отношении качества жизни больных, особенно при раннем ревматоидном артрите. Стоимость лечения лефлуномидом достаточно высока, поэтому он чаще назначается при наличии противопоказаний к применению метотрексата, его неэффективности или непереносимости, однако может использоваться и как первый базисный препарат.
-Сульфасалазин. В клинических испытаниях не уступал по эффективности другим БПВП, однако клиническая практика показывает, что достаточный контроль над течением болезни сульфасалазин обычно обеспечивает при умеренной и низкой активности ревматоидного артрита.
БПВП второго ряда применяются значительно реже в связи с меньшей
клинической эффективностью и/или большей токсичностью. Они назначаются, как
правило, при неэффективности или непереносимости БПВП первого ряда.
БПВП способны вызвать значительное улучшение (хороший клинический ответ) приблизительно у 60% пациентов. В связи с медленным развитием клинического эффекта назначение БПВП на сроки менее 6 мес. не рекомендуется. Длительность лечения определяется индивидуально, типичная продолжительность «курса» лечения одним препаратом (в случае удовлетворительного ответа на терапию) составляет 2–3 года и более. Большинство клинических рекомендаций подразумевают неопределенно долгое применение поддерживающих дозировок БПВП для сохранения достигнутого улучшения.
При недостаточной эффективности монотерапии каким-либо базисным препаратом может быть избрана схема комбинированной базисной терапии, т. е. сочетания двух-трех БПВП. Наиболее хорошо зарекомендовали себя следующие сочетания:
-метотрексат + лефлуномид;
-метотрексат + циклоспорин;
-метотрексат + сульфасалазин;
-метотрексат + сульфасалазин + гидроксихлорохин.
В комбинированных схемах препараты обычно применяются в средних дозировках. В ряде клинических исследований было продемонстрировано превосходство комбинированной базисной терапии над монотерапией, однако более высокая эффективность комбинированных схем не считается строго доказанной. Комбинация БПВП ассоциирована с умеренным повышением частоты побочных эффектов.
Биологические препараты в лечении ревматоидного артрита. (Генно-инженерные биологические препараты ГИБП)
Термин биологические препараты (от англ. biologics) применяется по отношению к лекарственным средствам, производимым с использованием биотехнологий и осуществляющим целенаправленное («точечное») блокирование ключевых моментов воспаления с помощью антител или растворимых рецепторов к цитокинам, а также другим биологически активным молекулам. Таким образом, биологические препараты не имеют никакого отношения к «биологически активным пищевым добавкам». В связи с большим количеством «молекул-мишеней», воздействие на которые потенциально может подавлять иммунное воспаление, разработан целый ряд лекарственных средств из этой группы и еще несколько препаратов проходят клинические испытания.
К основным, зарегистрированным в мире для лечения ревматоидного артрита биологическим препаратам относятся, нижеперечисленные:
-инфликсимаб, адалимумаб, этанерсепт (воздействуют на фактор некроза опухоли (ФНО-α);
-ритуксимаб (воздействует на CD 20 (В-лимфоциты);
-анакинра (воздействует на интерлейкин-1);
-абатасепт (воздействует на CD 80, CD 86, CD 28).
Для биологических препаратов характерны выраженный клинический эффект и достоверно доказанное торможение деструкции суставов. Эти признаки позволяют относить биологические препараты к группе БПВП. В то же время особенностью группы является быстрое (нередко в течение нескольких дней) развитие яркого улучшения, что объединяет биологическую терапию с методами интенсивной терапии. Они демонстрируют выраженное корригирующее действие на активность иммунного воспаления и ремоделирование артериального русла при серонегативном по РФ/АЦЦП варианте заболевания, что обосновывает целесообразность применения ритуксимаба и инфликсимаба на ранних стадиях развития, соответствующих клинико-иммунологических субтипов
заболевания, что позволит оптимизировать терапию и контролировать риск развития сердечно-сосудистых заболеваний у больных РА. Характерная черта биологических средств — потенцирование эффекта в сочетании с БПВП, в первую очередь с метотрексатом. В связи с высокой эффективностью при ревматоидном артрите, в том числе у резистентных к обычной терапии пациентов, в настоящее время биологическая терапия выдвинулась на второе по значимости место (после БПВП) в лечении этого заболевания. Назначение ГИБП должно сочетаться с выявлением скрытых и стёртых инфекционных заболеваний, так как в условиях данной терапии возрастает риск обострения латентных вирусных и бактериальных инфекционных заболеваний дыхательных путей (пневмония) и системы мочевыделения.
К отрицательным сторонам биологической терапии относятся:
-угнетение противоинфекционного и (потенциально) противоопухолевого иммунитета;
-риск развития аллергических реакций и индуцирования аутоиммунных синдромов, связанный с тем, что биологические препараты по химической структуре являются белками;
-высокая стоимость лечения.
Биологические методы терапии показаны, если лечение препаратами из группы БПВП (такими, как метотрексат) не является адекватным вследствие недостаточной эффективности или неудовлетворительной переносимости.
Одной из наиболее важных молекул-мишеней служит ФНО-а, который имеет множество провоспалительных биологических эффектов и способствуют персистенции воспалительного процесса в синовиальной оболочке, деструкции хряща и костной ткани за счет прямого действия на синовиальные фибробласты, хондроциты и остеокласты. Блокаторы ФНО-α являются наиболее широко применяемыми биологическими средствами в мире.
В России зарегистрирован препарат из этой группы инфликсимаб (ремикейд), представляющий собой химерное моноклональное антитело к ФНО-α. Препарат, как правило, назначается в сочетании с метотрексатом. У пациентов с недостаточной эффективностью терапии средними и высокими дозами метотрексата инфликсимаб существенно улучшает ответ на лечение и функциональные показатели, а также приводит к выраженному торможению прогрессирования сужения суставной щели и развития эрозивного процесса.
Показанием к назначению инфликсимаба в комбинации с метотрексатом является неэффективность одного или более БПВП, применявшихся в полной дозе (в первую очередь метотрексата), с сохранением высокой воспалительной активности (пять и более припухших суставов, скорость оседания эритроцитов (СОЭ) более 30 мм/ч, С-реактивный белок (СРБ) более 20 мг/л). При раннем ревматоидном артрите с высокой воспалительной активностью и быстрым нарастанием структурных нарушений в суставах комбинированная терапия метотрексатом и инфликсимабом может быть назначена сразу.
До назначения инфликсимаба требуется провести скрининговое обследование на туберкулез (рентгенография грудной клетки, туберкулиновая проба). Рекомендуемая схема применения: начальная доза 3 мг/кг массы тела больного в/в капельно, затем по 3 мг/кг массы тела через 2, 6 и 8 нед, далее по 3 мг/кг массы тела каждые 8 нед, при недостаточной эффективности доза может повышаться вплоть до 10 мг/кг массы тела. Длительность лечения определяется индивидуально, обычно не менее 1 года. После отмены инфликсимаба поддерживающая терапия метотрексатом продолжается. Следует иметь в виду, что повторное назначение инфликсимаба после окончания курса лечения этим препаратом ассоциировано с повышенной вероятностью реакций гиперчувствительности замедленного типа.
Вторым зарегистрированным в нашей стране препаратом для проведения биологической терапии является ритуксимаб (мабтера). Действие ритуксимаба направлено на подавление В-лимфоцитов, которые не только являются ключевыми клетками, отвечающими за синтез аутоантител, но и выполняют важные регуляторные функции на ранних стадиях иммунных реакций. Препарат обладает выраженной клинической эффективностью, в том числе у больных, недостаточно отвечающих на терапию инфликсимабом.
Для лечения ревматоидного артрита препарат применяется в дозе 2000 мг на курс (две инфузии по 1000 мг, каждая с промежутком в 2 нед). Ритуксимаб вводится внутривенно медленно, рекомендуется проведение инфузии в условиях стационара с возможностью точного контроля за скоростью введения. Для профилактики инфузионных реакций целесообразно предварительное введение метилпреднизолона 100 мг. При необходимости возможно проведение повторного курса инфузий ритуксимаба через 6–12 мес.
Согласно европейским клиническим рекомендациям, ритуксимаб целесообразно назначать в случаях неэффективности или невозможности проведения терапии инфликсимабом. Возможность применения ритуксимаба в качестве первого биологического препарата служит в настоящее время предметом исследований.
ГЛЮКОКОРТИКОСТЕРОИДЫ
Глюкокортикостероиды обладают многогранным противовоспалительным действием, обусловленным блокадой синтеза провоспалительных цитокинов и простагландинов, а также торможением пролиферации за счет воздействия на генетический аппарат клеток.
Глюкокортикостероиды оказывают быстрый и ярко выраженный дозозависимый эффект в отношении клинических и лабораторных проявлений воспаления. Применение глюкокортикостероидов чревато развитием нежелательных реакций, частота которых также повышается с увеличением дозы препарата (стероидный остеопороз, медикаментозный синдром Иценко–Кушинга, поражение слизистой ЖКТ). Эти препараты сами по себе в большинстве случаев не могут обеспечить полноценного контроля над течением ревматоидного артрита и должны назначаться вместе с БПВП.
Глюкокортикостероиды при данном заболевании применяются системно и локально. Для системного применения показан основной метод лечения — назначение низких доз внутрь (преднизолон — до 10 мг/сут, метилпреднизолон — до 8 мг/сут) на длительный период при высокой воспалительной активности, полиартикулярном поражении, недостаточной эффективности БПВП.
Средние и высокие дозы глюкокортикостероидов внутрь (15 мг/сут и более, обычно 30–40 мг/сут в пересчете на преднизолон), а также пульс-терапия глюкокортикостероидами — внутривенное введение высоких доз метилпреднизолона (250–1000 мг) или дексаметазона (40–120 мг) могут применяться для лечения тяжелых системных проявлений ревматоидного артрита (выпотной серозит, гемолитическая анемия, кожный васкулит, лихорадка и др.), а также некоторых особых форм болезни.
Продолжительность лечения определяется временем, необходимым для купирования симптоматики, и составляет обычно 4–6 нед, после чего осуществляется постепенное ступенчатое снижение дозы с переходом на лечение низкими дозами глюкокортикостероидов.
Глюкокортикостероиды в средних и высоких дозах, пульс-терапия, по-видимому, не обладают самостоятельным влиянием на течение ревматоидного артрита и развитие эрозивного процесса в суставах.
Для локальной терапии применяются препараты в микрокристаллической форме, назначающиеся в виде внутрисуставных и периартикулярных инъекций: бетаметазон, триамсинолон, метилпреднизолон, гидрокортизон.
Глюкокортикостероиды для локального применения обладают ярко выраженным противовоспалительным действием, преимущественно в месте введения, а в ряде случаев — и системным действием. Рекомендуемые суточные дозы составляют: 7 мг — для бетаметазона, 40 мг — для триамсинолона и метилпреднизолона, 125 мг — для гидрокортизона. Эта доза (суммарно) может использоваться для внутрисуставного введения в один крупный (коленный) сустав, два сустава среднего размера (локтевые, голеностопные и др.), 4–5 мелких суставов (пястно-фаланговые и др.), либо для периартикулярного введения препарата в 3–4 точки.
Эффект после однократного введения обычно наступает на протяжении 1–3 дней и сохраняется в течение 2–4 нед при хорошей переносимости. В связи с этим повторные инъекции глюкокортикостероидов в один сустав нецелесообразно назначать ранее, чем через 3–4 недели. Проведение курса из нескольких внутрисуставных инъекций в один и тот же сустав не имеет терапевтического смысла и чревато осложнениями (локальный остеопороз, усиление деструкции хряща, остеонекроз, нагноение). В связи с повышенным риском развития остеонекроза внутрисуставное введение глюкокортикостероидов в тазобедренный сустав в целом не рекомендуется.
Глюкокортикостероиды для локального применения назначаются в качестве дополнительного метода купирования обострений ревматоидного артрита и не могут служить заменой системной терапии.
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ
Значение НПВП в лечении ревматоидного артрита за последние годы существенно снизилось в связи с появлением новых эффективных схем патогенетической терапии. Противовоспалительное действие НПВП достигается с помощью подавления активности ЦОГ, или избирательно ЦОГ-2, и тем самым снижается синтез простагландинов. Таким образом, НПВП действуют на конечное звено ревматоидного воспаления.
Действие НПВП при ревматоидном артрите — уменьшение выраженности симптомов болезни (боль, скованность, припухлость суставов). НПВП обладают обезболивающим, противовоспалительным, жаропонижающим эффектом, но мало влияют на лабораторные показатели воспаления. В подавляющем большинстве случаев НПВП не способны как-либо заметно изменить течение заболевания. Их назначение в качестве единственного противоревматического средства при достоверном диагнозе ревматоидный артрит в настоящее время считается ошибкой. Тем не менее НПВП являются основным средством симптоматической терапии при данном заболевании и в большинстве случаев назначаются в сочетании с БПВП.
Наряду с лечебным эффектом, все НПВП, включая селективные (ингибиторы ЦОГ-2), способны вызывать эрозивно-язвенное поражение ЖКТ (в первую очередь верхних его отделов — «НПВП-гастропатия») с возможными осложнениями (кровотечения, перфорации и пр.), а также нефротоксические и другие нежелательные реакции.
Основные характерные черты, которые необходимо учитывать при назначении НПВП, следующие.
-Не существует значимых различий между НПВП в плане эффективности (для большинства препаратов эффект пропорционален дозе вплоть до максимальной рекомендуемой).
-Существуют значительные различия между разными НПВП по переносимости, особенно в отношении поражения ЖКТ.
-Частота нежелательных эффектов обычно пропорциональна дозе НПВП.
У пациентов с повышенным риском развития НПВП-ассоциированного поражения ЖКТ риск может быть снижен путем параллельного назначения блокаторов протонной помпы, мизопростола.
Существует индивидуальная чувствительность к различным НПВП как в отношении эффективности, так и переносимости лечения. Дозы НПВП при ревматоидном артрите соответствуют стандартным.
Продолжительность лечения НПВП определяется индивидуально и зависит от потребности больного в симптоматической терапии. При хорошем ответе на терапию БПВП препарат из группы НПВП может быть отменен.
К наиболее часто применяющимся при ревматоидном артрите НПВП относятся:
диклофенак (50–150 мг/сут);
нимесулид (200–400 мг/сут);
целекоксиб (200–400 мг/сут);
мелоксикам (7,5–15 мг/сут);
ибупрофен (800–2400 мг/сут);
лорноксикам (8–12 мг/сут).
Селективные НПВП, по эффективности достоверно не отличаясь от неселективных, реже вызывают НПВП-гастропатии и серьезные нежелательные реакции со стороны ЖКТ, хотя и не исключают развитие этих осложнений. Ряд клинических исследований продемонстрировал повышенную вероятность развития тяжелой сосудистой патологии (инфаркт миокарда, инсульт) у пациентов, получавших препараты из группы коксибов, в связи, с чем возможность лечения целекоксибом должна обсуждаться с особой осторожностью у больных с ИБС и другими серьезными кардиоваскулярными патологиями.
ДОПОЛНИТЕЛЬНЫЕ МЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
В качестве симптоматического анальгетика (или дополнительного анальгетика при недостаточной эффективности НПВП) может использоваться парацетамол (ацетаминофен) в дозе 500–1500 мг/сут, который обладает относительно невысокой токсичностью. Для локальной симптоматической терапии используются НПВП в виде гелей и мазей, а также диметилсульфоксид в виде 30–50% водного раствора в форме аппликаций. При наличии остеопороза показано соответствующее лечение препаратами кальция, витамина Д3, бифосфонатами, кальцитонином.
ОБЩИЕ ПРИНЦИПЫ ВЕДЕНИЯ БОЛЬНЫХ РА
Больному с установленным диагнозом ревматоидный артрит должен быть назначен препарат из группы БПВП, который при хорошем клиническом эффекте может применяться как единственный метод терапии. Другие лечебные средства используются по мере необходимости.
Больной должен быть информирован о характере своего заболевания, течении, прогнозе, необходимости длительного сложного лечения, а также о возможных нежелательных реакциях и схеме контроля за лечением, неблагоприятных сочетаниях с другими препаратами (в частности, алкоголем), возможной активации очагов хронической инфекции на фоне лечения, целесообразности временной отмены иммуносупрессивных препаратов при возникновении острых инфекционных заболеваний, о необходимости контрацепции на фоне лечения.
Терапия ревматоидного артрита должна назначаться врачом-ревматологом и проводиться под его наблюдением. Лечение биологическими препаратами может проводиться только под контролем ревматолога, имеющего достаточные знания и опыт для его проведения. Терапия является длительной и подразумевает периодический контроль активности болезни и оценку ответа на терапию.
Рисунок 2. Упрощенный алгоритм терапии.
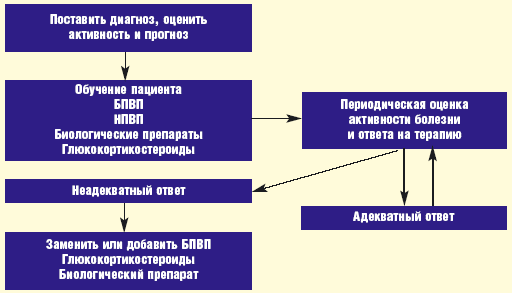
Мониторинг активности болезни и ответа на терапию включает оценку показателей суставного статуса (число болезненных и припухших суставов и др.), острофазовых показателей крови (СОЭ, СРБ), оценку боли и активности болезни по визуальной аналоговой шкале, оценку функциональной активности больного в повседневной деятельности с помощью русского варианта опросника состояния здоровья (HAQ). Существуют признанные международным сообществом ревматологов методики количественной оценки ответа на лечение с помощью рекомендованного Европейской лигой по борьбе с ревматизмом (EULAR) индекса DAS (Disease Activity Score) и критериев Американской коллегии ревматологов (ACR). Кроме того, должен осуществляться мониторинг безопасности проводимой пациенту терапии (в соответствии и формуляром и существующими клиническими рекомендациями).
В связи с тем, что эрозивный процесс может развиваться даже при низкой воспалительной активности, помимо оценки активности болезни и ответа на терапию обязательно применяется рентгенография суставов. Прогрессирование деструктивных изменений в суставах оценивают путем стандартной рентгенографии кистей и стоп с использованием рентгенологической классификации стадий ревматоидного артрита, количественных методик по индексам Sharp и Larsen. С целью мониторинга состояния больного обследование рекомендуется проводить с определенной периодичностью.
ЛЕЧЕНИЕ РЕЗИСТЕНТНОГО К ТЕРАПИИ РА
Резистентным к лечению целесообразно считать пациента с неэффективностью (отсутствием 20% улучшения по основным показателям) как минимум двух стандартных БПВП в достаточно высоких дозах (метотрексат — 15–20 мг/нед, сульфасалазин — 2000 мг/сут, лефлуномид — 20 мг/сут). Неэффективность может быть первичной и вторичной (возникающей после периода удовлетворительного ответа на терапию либо при повторном назначении препарата). Существуют следующие пути преодоления резистентности к терапии:
-назначение биологических препаратов (инфликсимаб, ритуксимаб);
-назначение глюкокортикостероидов;
-применение комбинированной базисной терапии;
-применение БПВП второго ряда (циклоспорин и др.).
С точки зрения отдаленных результатов в отношении функциональных нарушений, качества жизни и ее продолжительности оптимальной стратегией терапии ревматоидного артрита является многолетнее лечение БПВП с планомерной сменой схемы их применения по мере необходимости.
НОВЕЙШИЕ МЕТОДИКИ ЛЕЧЕНИЯ РА С ПРИМЕНЕНИЕМ
ЭКСТРАКОРПОРАЛЬНОЙ ГЕМОКОРРЕКЦИИ.
Традиционное медикаментозное лечение РА, включающее систематическое применение довольно большого количества лекарственных препаратов разнопланового действия, и принципы его проведения не могут удовлетворить практикующих врачей, поскольку они приводят к более-менее продолжительной ремиссии и восстановлению трудоспособности не более чем у 2/3 больных. При этом практически все применяемые в настоящее время при лечении РА лекарственные средства обладают выраженными побочными эффектами. По этой причине вполне понятен и оправдан поиск новых, более эффективных и безопасных методов лечения РА. В начале 60-х годов прошлого века были проведены первые попытки удаления из организма циркулирующих иммунных комплексов и активированных лимфоцитов с помощью Экстракорпоральной гемокоррекции. В начале 80-х годов впервые применили лимфацитоферез и плазмолейкоцитаферез для лечения РА и добились отчётливого положительного эффекта.Но ряд последующих исследований не показал стабильности изменений иммунологических показателей при проведении вышеперечисленных технологий Экстракорпоральной гемокоррекции.
По настоящему существенного, по сравнению с методами медикаментозной терапии, преимущества применения Экстракорпоральной гемокоррекции в лечении РА удалось добиться только в середине 90-х годов, когда были использованы новые технологии Экстракорпоральной гемокоррекции: КРИОМОДИФИКАЦИЯ АУТОПЛАЗМЫ, позволяющая селективно удалить из организма факторы патогенности, участвующие в прогрессировании РА и ИНКУБАЦИЯ ЛЕЙКОЦИТАРНОЙ МАССЫ С ИММУНОМОДУЛЯТОРАМИ, позволяющая изменить активность иммунной системы в желаемом направлении, не подавляя общей иммунной защиты организма. Показано, что Криомодификация аутоплазмы удаляет от 30 до 50% таких метаболитов, принимающих участие в развитии патологического процесса, как: липопротеиды ( преимущественно низкой плотности и «модифицированные») продукты деградации фибриногена-фибрина, коллаген, ДНК, активатор плазминогена тканевого типа,СЗ-компонент комплемента, бактерии, грибы, вирусы, ЦИК, Ig М, А, G, фрагменты тканевого детрита, клетлчные мембраны и некоторые олигопептиды, более 80% криоглобулинов, около 90% фибронектина при сохранении 85% альбумина.
Экстракорпоральная обработка лейкоцитов иммуномодуляторамиимеет следующие преимущества:
- клетки во время обработки препаратом находятся вне контроля факторов, образующихся в организме пациента и препятствущих активации клеток in vivo,
- препарат не вводится непосредственно пациенту, что исключает побочные реакции и осложнения и позволяет применить его в концентрациях намного превышающих терапевтические.
Использование этих технологий в комплексном лечении РА позволяет достичь стойкой и продолжительной ремиссии РА более чем в 90% случаев.
Поскольку во всех случаях эти методики применялись на фоне базисной медикаментозной терапии, не оказывавшей до того существенного влияния на динамику РА, можно считать, что положительный эффект у данных больных РА достигался именно благодаря этим технологиям.
ЗАКЛЮЧЕНИЕ
Итак, если сделать вывод из вышеизложенного, то для практикующего врача становится понятным, что главным в вопросе лечения ревматоидного артрита является отсутстствие понимания подлинной этиологии заболевания, последствием которого являются случаи резистентного к лечению РА. Все имеющиеся методики лечения направлены на ликвидацию последствий и симптомов проявления заболевания, то есть в лучшем случае патогенетическая, а в основном симптоматическая терапия, успехи, в которых за последние годы и позволили добиться целей, поставленных перед практикующими врачами.
Но главной, на перспективу, является необходимость искать и найти подлинные причины возникновения болезни, что позволит изыскать препараты и методики их применения, позволяющие добиться не просто улучшения в ситуации больных, а полного и раннего их излечения.
ЛИТЕРАТУРА.
1. Клинические рекомендации. Ревматология/ под. ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2008г. 288 с.
2. Насонов Е. Л., Каратеев Д. Е., Чичасова Н. В., Чемерис Н. А. Современные стандарты фармакотерапии ревматоидного артрита// Клиническая фармакология и терапия. 2005. Т. 14. № 1. С. 72–75.
3. Каратеев Д.Е. Вопросы безопасности терапии ингибиторами ФНО-альфа //Современная ревматология. 2009. №3 С733-738с.
4. Каратеев Д.В. Ритуксимаб в современной терапии ревматоидного артрита//НИИ ревматологии РАМН Актуальные обзоры, Фарматека №5 2010, Москва.
5. Бадокин В.В. Диагностика и современная терапия ревматоидного артрита. //Журнал «Медицинский совет» №№ 7-8 2010г.
6. Балабанова Р. М., Каратеев Д. Е., Кашеваров Р. Ю., Лучихина Е. Л. Лефлуномид (Арава) при раннем ревматоидном артрите// Научно-практическая ревматология. 2005. № 5. С. 31–34.
7. Каратеев Д. Е. Ретроспективная оценка многолетней базисной терапии у больных ревматоидным артритом// Научно-практическая ревматология. 2003. № 3. С. 32–36.
8. Назаров В.Д., Саидов Ё.У., Халилова Д.А., Зубайдов Р.Н., Шодиев Б.Р.
Ревматоидный артрит с системными проявлениями: диагностика, индикаторы неблагоприятного течения. Научно-практическая ревматология.2012;50(6):45-49.
9. Иванова И.П., Селедцова Г.В., Мамаев С.В., Литвинова Л.С., Лопатникова Ю.А., Сенников С.В., Селедцов В.И. Изменение параметров иммунной системы в процессеТ-клеточной вакцинации у больных ревматоидным артритом. Российский иммунологический журнал. -2011, том 5(14), №3-4
С.341-349.
10. Мещерина Н.А. Диссертация на соискание учёной степени доктора медицинских наук: «Подходы к коррекции активности иммунного воспаления и ремоделирования кардиоваскулярного русла у больных ревматоидным артритом генно-инженерными биологическими препаратами»
Курск 2014г.
11. Аксёнов М.В., Пятых Е.А. Возможности использования генно- инженерных биологических препаратов в лечении ревматоидного артрита. Балтийский Федеральный Университет имени Иммануила Канта. Медицинский институт Калининград, Россия.7-я Международная студенческая элекетронная конференция «Студенческий научный форум» -2015.
12. Анонс Центра Экстракорпоральной гемокоррекции о новых методиках лечения РА. Мамаев С.В. Москва 2015г.














 (zip - application/zip)
(zip - application/zip)