Министерство
образования и науки Российской Федерации
Министерство
образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
Высшего профессионального образования
«ЮЖНО-УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(национальный исследовательский университет)
Факультет «Заочный инженерно-экономический»
Кафедра «Безопасность жизнедеятельности»
Направление 280700 «Техносферная безопасность»
КУРСОВАЯ РАБОТА
По дисциплине: Теория горения и взрывов
ВЫПОЛНИЛ
Студент группы ТБ-344
______________Д.О. Ануфриев
«____»_______________ 2016 г.
Работа защищена
с оценкой (цифрой, прописью)
__________________________
«____»______________ 2016 г.
Челябинск 2016
 Содержание
Содержание
Введение………………………………………………...……..……….…….3
1. Определение объема воздуха (окислителя), необходимого для полного сгорания единицы массы (объема) горючего вещества………………4
2 Расчет объема и состава продуктов горения..............................................11
3.Определение концентрационных пределов распространения пламени (воспламенения)……………………..………………………………………….....17
4. Определение состава и расчет объема продуктов взр. разл. ………...27
5. Теплота и температура взрыва………………………………………...…32
6. Расчёт температуры продуктов взрыва…………………………...……..42
7. Давление продуктов взрыва……………………………..……………….44
Список используемой литературы ……………..……………...…………...49
 Вариант
1
Вариант
1
Введение
В технологических процессах, связанных с добычей, транспортировкой, переработкой, получением, хранением и применением горючих газов (ГГ) и легковоспламеняющихся жидкостей (ЛВЖ), всегда имеется опасность образования взрывоопасных газо- и паровоздушных смесей.
Взрывоопасную среду могут образовать смеси веществ (газов, паров, пылей) с воздухом и другими окислителями (кислород, озон. хлор, окислы азота и др.) и вещества, склонные к взрывному превращению (ацетилен, озон, гидразин и др.).
Причинами взрывов наиболее часто является нарушение правил безопасной эксплуатации оборудования, утечки газов через неплотности в соединениях, перегрев аппаратов, чрезмерной повышение давления, отсутствие надлежащего контроля за технологическим процессом, разрыв или поломка деталей оборудования и др.
Источником инициирования взрыва являются:
открытое пламя, горящие и раскаленные тела;
электрические разряды;
- тепловые проявления химических реакций и механических воздействий;
искры от удара и трения:
ударные волны;
- электромагнитные и другие излучения.
1. Определение объема воздуха (окислителя), необходимого для полного сгорания единицы массы (объема) горючего вещества
 1.1.
Общие положения
1.1.
Общие положения
В основе процесса горения лежит реакция окисления горючих материалов [1, 2]. Материальный баланс процесса горения выражает количественное соотношение между исходными продуктами (горючее и окислитель) и конечными (продукты сгорания), отнесённое к единице объёма или массы горючего.
Теоретической базой для расчетов материального и теплового балансов являются фундаментальные законы сохранения вещества и энергии. Определение расхода воздуха при горении различных горючих веществ, их соединений и смесей имеет важное практическое значение (особенно с позиций пожаробезопасности). Объём воздуха, требуемый для сгорания единицы объёма горючего вещества, превышает его в несколько раз. Поэтому в условиях пожара не следует стремиться к увеличению доступа воздуха в зону горения: одним из способов пожаротушения является сокращение и препятствие притока кислорода воздуха к очагу горения. Процесс горения при уменьшении кислорода в воздухе с 21 до 18 % тормозится, а при достижении 10 % практически все горючие вещества прекращают гореть. С другой стороны, многие горючие вещества содержат в своём составе кислород. Поэтому иногда горение продолжается и при ликвидации доступа кислорода в зону горения. Известно множество случаев, когда после тушения пожара, он через некоторое время возобновлялся.
Практически при горении во время пожара расходуется воздуха значительно больше теоретически необходимого. Разность между количеством воздуха, практически расходуемого на горение, и теоретически необходимого, называется избытком воздуха. Отношение же количества воздуха, практически расходуемого на горение, к теоретически необходимому, называется коэффициентом избытка воздуха.
В условиях пожара, когда горение
протекает с естественным притоком воздуха, коэффициент избытка воздуха можно
определить по составу продуктов  сгорания,
если произвести их газовый анализ. Учитывая, что концентрация кислорода в
воздухе составляет 21 %, а процентное содержание свободного кислорода в
продуктах сгорания определяется из анализа, можно определить коэффициент
избытка воздуха.
сгорания,
если произвести их газовый анализ. Учитывая, что концентрация кислорода в
воздухе составляет 21 %, а процентное содержание свободного кислорода в
продуктах сгорания определяется из анализа, можно определить коэффициент
избытка воздуха.
1.2. Расчет количества воздуха, необходимого для горения веществ
В большинстве реакций горения в качестве окислителя служит кислород. В чистом виде кислород в природе не встречается, но является составной частью воздуха. Большинство пожаров (реакций горения) происходит именно на воздухе (открытом или в помещениях). Состав атмосферного воздуха достаточно сложен. Кроме основных компонентов – азота и кислорода, в нём содержатся инертные газы (в основном аргон). Однако, содержание инертных газов незначительно – менее 1 %. Поэтому для практических расчетов принимают содержание кислорода 21 % и азота – 79 %.
Азот при нормальных условиях в процессе горения участия не принимает, так как является инертным газом (образование высокотоксичных оксидов азота возможно лишь при высоких температурах). Таким образом, объемное соотношение азота и кислорода в воздухе составляет:

(1.1)
где, φN2 ,φO2 – соответственно объемное (% об.) содержание азота и кислорода в окислительной среде.
Следовательно, на 1 моль кислорода приходится 3,76 моля азота.
Данное соотношение используется при составлении реакции горения.
Для газообразных горючих материалов расчёт материального баланса чаще всего проводят в м3/м3 (для сгорания 1 м3 газообразного горючего материала требуется определённое количество м3 воздуха).
Для твёрдых или жидких горючих материалов (ГМ) расчёт материального баланса проводят в м3/кг (для сгорания 1 кг твёрдого или жидкого горючего материала требуется определённое количество м3 воздуха).
 Наиболее
распространённые горючие материалы разделяют на три группы: индивидуальные
химические соединения и технические продукты, вещества сложного состава, смеси
газов.
Наиболее
распространённые горючие материалы разделяют на три группы: индивидуальные
химические соединения и технические продукты, вещества сложного состава, смеси
газов.
Формулы для расчёта количества воздуха, необходимого для полного сгорания единицы горючего материала, приведены ниже [3, 4].
1. Индивидуальные химические соединения и технические продукты:
1.1. Газообразные ГМ:

(1.2)
1.2. Твёрдые и жидкие ГМ:

(1.3)
2. Вещества сложного состава:

(1.4)
3. Смесь газов:

(1.5)
где VВ0 –
теоретическое количество воздуха (количество воздуха, необходимое для полного
сгорания единицы массы (кг) или объёма (м3) горючего вещества); nг,
nО2,nN2
– количество горючего, кислорода и азота, получаемого из уравнения химической
реакции горения, моль; МГ – молекулярная масса горючего; V0
– объем 1 моля газа при нормальных условиях (22,4 м3); С, Н, S, О –
массовое содержание соответствующих элементов в составе горючего, %; φГi
– концентрация i-го горючего компонента, % об.; φO2 –
концентрация кислорода в  составе
горючего газа, % об.; nO2i
– количество кислорода, необходимое для окисления одного моля i-го горючего
компонента, моль.
составе
горючего газа, % об.; nO2i
– количество кислорода, необходимое для окисления одного моля i-го горючего
компонента, моль.
Уравнения (1.2–1.5) предназначены для определения теоретического объёма воздуха (окислительной среды) при нормальных условиях. Для определения объема воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов:

(1.6)
где Р0 – нормальное давление, Па; Т0 – нормальная температура, К; V0 – объем воздуха при нормальных условиях; P1, V1, Т1 – соответственно давление, объем и температура воздуха, характеризующие заданные условия горения.
Следовательно, объём воздуха (окислительной среды), необходимый для сгорания вещества при условиях, отличных от нормальных, определяется по формуле:
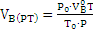
(1.7)
При горении расход воздуха может отличаться от теоретически необходимого. Отношение количества воздуха, участвовавшего в горении (практическое количество воздуха VВ) к теоретически необходимому, называется коэффициентом избытка воздуха α:

(1.8)
Разность между практическим и теоретическим объемами воздуха называется избытком воздуха ∆VB:
∆VB
= VB – VB0
(1.9)
Для стехиометрической смеси α = 1, ∆VВ = 0.
В случае если горение происходит с избытком воздуха (α > 1).
Для определения массы воздуха, поступившего для горения, используют следующее уравнение:
 mв
= Vв × rв,
mв
= Vв × rв,
(1.10)
где rв – плотность воздуха, кг/м3
Плотность воздуха rв определяется как:
 (1.11)
(1.11)
Если в уравнение (1.11) подставить значения постоянных, то получим:

(1.12)
где P - атмосферное давление в условиях горения, Па; Т - температура воздуха в условиях горения, К.
Задача 1.1
Определить объем воздуха, необходимого для полного сгорания 1 кг гидразина (ЛВ и ВОЖ) N2H4. Т = 305 К, Р = 101300 Па, α = 1,8.
Решение:
1. Запишем уравнение химической реакции гидразина в воздухе:
N2H4 + О2 + n×3,76N2 = 2H2O + N2 + 1×3,76N2
2. Определяем теоретический объема воздуха, необходимый для сгорания 1 кг гидразина:

3. Определяем практический объем воздуха:

4. По условиям задачи коэффициент избытка α = 1,8. С учетом этого определим практический объем воздуха, необходимого для горения:
VB0
=
3,797 × 1,8 = 6,8 
Ответ: для сгорания 1 кг гидразина требуется 6,8 м3 воздуха при
 Т
= 305 К и Р = 101300 Па
Т
= 305 К и Р = 101300 Па
Задача 1.2
Определить объём воздуха необходимого для полного сгорания 1 кг сосны, в состав которого входит С = 46,15 %; Н = 5,38 %; О = 39,15%; N = 0,80 % W = 7,0 % (содержание влаги); А = 1,1 % (содержание золы), при давлении Р = 101300 Па и температуре Т = 305 К
Решение:
1. Определим теоретический объём воздуха, необходимый для полного
сгорания 1 кг сосны при нормальных условиях:

2. Определим практический объём воздуха:

Ответ: для сгорания 1 кг сосны при условиях, отличных от нормальных, требуется 4,89 м3 воздуха
Задача 1.3
Определить объем окислительной среды, состоящей из 75 % O2 и 25 % N2, необходимый для горения 3 кг глицерина, если ее температура равна 305 К, давление 101,3 кПа, α = 1,8.
Решение:
 Так
как окислительная среда отличается по составу от воздуха, объемное соотношение
кислорода и азота:
Так
как окислительная среда отличается по составу от воздуха, объемное соотношение
кислорода и азота:

1. Уравнение реакции горения изопропилового спирта:
C3H8O3 + (3+8/4-3/2) О2 + n0,33N2 = 3CO2 + 4H2O + 3,83N2
2. Теоретический объем окислительной среды при нормальных условиях:


для сгорания 1 кг глицерина при Т = 305 К и Р = 101,3 кПа необходимо 1,81 м3 заданной окислительной среды.
3. По условиям задано m = 3 кг, тогда:

А так как α = 1,8, то практический объем будет равен:

Ответ: для сгорания 3 кг глицерина при Т = 305 К и Р = 101,3 кПа необходимо 9,77 м3 заданной окислительной среды.
Задача 1.4
Определить объем воздуха, необходимого для горения 1 м3 смеси газов – газ природный: СН4 = 93%, N2=2,0% CO2=0,8%; C2H6=2,7%; C3H8=1,0%; C4H10=0,1%; iC4H10=0,2%; C5H12 = 0,1%, iC5H12 = 0,1%. T = 300 К, давление 101325 Па, α = 2,5.
Решение:
1. В горении участвуют:
СН4 + 2О2 + 2×3,76N2 = CO2 + 2H2O + 2×3,76N2
C2H6+ 3,5О2 + 3,5×3,76N2 = 2CO2 + 3H2O + 3,5×3,76N2
C3H8+ 5О2 + 5×3,76N2 = 3CO2 + 4H2O + 5×3,76N2
C4H10+ 6,5О2 + 6,5×3,76N2 = 4CO2 + 5H2O + 6,5×3,76N2
iC4H10+ 6,5О2 + 6,5×3,76N2 = 4CO2 + 5H2O + 6,5×3,76N2
 C5H12+ 6,5О2 + 8×3,76N2 = 5CO2 + 6H2O + 8×3,76N2
C5H12+ 6,5О2 + 8×3,76N2 = 5CO2 + 6H2O + 8×3,76N2
iC5H12+ 6,5О2 + 8×3,76N2 = 5CO2 + 6H2O + 8×3,76N2
2. Для расчета теоретического объема воздуха, необходимого для сгорания 1 м3 газа сланцевого бытового при нормальных условиях, используем формулу для смеси газов:

3. Для определения объема воздуха при горении в условиях, отличаю- щихся от нормальных, используем уравнение:

4. По условиям задачи коэффициент избытка α = 2,5. С учетом этого определим практический объем воздуха, необходимого для горения:
VB0
= 10,67 × 2,5 = 26,68 
Ответ: для сгорания 1 м3 газа природного при Т = 300 К и Р = 103325 Па необходимо 26,68 м3 воздуха.
2. Расчет объема и состава продуктов горения
2.1. Общие положения
В результате процесса горения образуются газообразные, жидкие и
твёрдые вещества, называемые продуктами горения. Состав продуктов горения
зависит от природы горючих веществ и от количественного соотношения горючего и
окислителя [5]. В зависимости от количественного соотношения горючего и
окислителя различают три разновидности горючих смесей: стехиометрическая смесь,
которая не содержит в избытке ни горючего компонента, ни окислителя;  богатая смесь, содержащая в избытке горючее; бедная смесь,
содержащая в избытке окислитель. При сгорании стехиометрической или бедной
смеси образуются продукты полного сгорания компонентов горючих веществ (главным
образом органических): углерода С – диоксид углерода СО2; водорода Н
– вода Н2О; серы S – диоксид серы SO2 и т. д. Азот,
входящий в горючее вещество выделяется в свободном виде N2. При
сгорании богатой смеси (недостаток окислителя) состав продуктов сгорания более
разнообразен. Здесь могут образовываться оксид углерода – СО, сажа – С,
различные радикалы (ОН, СН), спирты, кетоны, альдегиды и другие продукты. В
теоретических расчетах объёма продуктов горения, так же, как и при расчётах
объёма воздуха, наиболее распространённые горючие материалы разделяют на три
группы: индивидуальные химические соединения и технические продукты, вещества
сложного состава, смеси газов.
богатая смесь, содержащая в избытке горючее; бедная смесь,
содержащая в избытке окислитель. При сгорании стехиометрической или бедной
смеси образуются продукты полного сгорания компонентов горючих веществ (главным
образом органических): углерода С – диоксид углерода СО2; водорода Н
– вода Н2О; серы S – диоксид серы SO2 и т. д. Азот,
входящий в горючее вещество выделяется в свободном виде N2. При
сгорании богатой смеси (недостаток окислителя) состав продуктов сгорания более
разнообразен. Здесь могут образовываться оксид углерода – СО, сажа – С,
различные радикалы (ОН, СН), спирты, кетоны, альдегиды и другие продукты. В
теоретических расчетах объёма продуктов горения, так же, как и при расчётах
объёма воздуха, наиболее распространённые горючие материалы разделяют на три
группы: индивидуальные химические соединения и технические продукты, вещества
сложного состава, смеси газов.
2.2. Определение объема и состава продуктов горения
Для расчёта количества продуктов горения, образующихся при полном сгорании единицы горючего материала, используют следующие формулы [3, 4]:
1. Индивидуальные химические соединения и технические продукты.
1.1. Газообразные ГМ:

(2.1)
1.2.Твёрдые и жидкие ГМ:

(2.2)
2.Вещества сложного состава:

(2.3)

(2.4)

(2.5)
 (2.6)
(2.6)
3. Смесь газов: ПГ


(2.7)

(2.8)
где VПГ0 - теоретический объем продуктов горения; nПГi - количество i-го продукта горения в уравнении реакции, кмоль; nГ - количество горючего, кмоль; V0 - объем 1 кмоля газа; М - молекулярная масса горючего; VПГi - объем i-го продукта реакции; C, H, S, O, N, W - содержание соответствующих элементов (углерода, водорода, серы, кислорода, и азота) и влаги в горючем веществе, % вес; φГi - содержание i-го горючего компонента в газовой смеси, % об.; φНГi - содержание i-го негорючего компонента в составе газовой смеси, % об.
Если процесс горения происходит при избытке воздуха (α > 1), в про- дуктах горения содержится большее количество кислорода и азота:

(2.9)

(2.10)
где ∆VВ – разность между практическим и теоретическим объемами воздуха (избыток воздуха); VN20- теоретический объем азота в продуктах горения, м3:
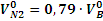
(2.11)
В этом случае теоретический объём продуктов горения определяется:
VПГ = VСО + VНО + VN + VО, м3
(2.12)
Практический объем продуктов горения определяется:

(2.13)
Или

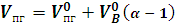 (2.14)
(2.14)
Задача 2.1
Определить объем продуктов горения 1 кг акролеина С3Н4О с молярной массой М = 56,06, температурой Т = - 100C и Р = 99900 Па.
Решение
1. Запишем уравнение химической реакции горения горючего вещества:
С3Н4О + 3,5О2 + 3,5×3,76N2 = 3CO2 + 2H2O + 3,5×3,76N2
2. Определим теоретический объем продуктов горения:

3. Определим объем продуктов горения при заданных условиях:

Ответ: при горении 1 кг акролеина при заданных условиях образуется 7,1 м 3 продуктов горения.
Задача 2.2
Определить объём продуктов горения при сгорании 1 кг керосина осветительного C10,914H21,832. Молярная масса 153,1. Давление Р = 99900 Па, температура Т = 10 °С.
Решение
1. Запишем уравнение реакции горения:
С10,914Н21,832 + 16,372О2 + 16,372×3,76N2 = 10,914CO2 + 10,916H2O + 16,372×3,76N2
2. Определим теоретический объём продуктов горения при нормальных условиях:

3. Определим объем продуктов горения при заданных условиях:

 Ответ:
при горении 1 кг керосина осветительного при заданных условиях образуется 12,83
м 3 продуктов горения.
Ответ:
при горении 1 кг керосина осветительного при заданных условиях образуется 12,83
м 3 продуктов горения.
Задача 2.3
Определить объем продуктов горения при сгорании 1 кг хлопка: С = 42,19%; Н = 5,43%; О = 46,39%; N = 0,47%; W = 4,0; А = 0,5.
Решение
1. Определим теоретические объёмы каждого из продуктов горения:



2. Определим суммарный теоретический объем продуктов горения:

Ответ: при сгорании 1 кг хлопка образуется 4,32 м3 продуктов горения.
Задача 2.4
Рассчитать объем продуктов горения при сгорании 1 м3 газовой смеси (газ полукоксовый), состоящей из СО2 - 0,4%, Н2 – 9,3%, С2Н4 – 21,8%, С3Н8 – 9,0%, С2N2 – 19,6%, O2 – 0,8%, CO – 18,5%, N2 – 20,6%, если температура горения 340 К, Р = 90700 Па, коэффициент избытка воздуха 1,8.
Решение:
 1.
Запишем уравнения химической реакции горения все составляющих:
1.
Запишем уравнения химической реакции горения все составляющих:
C2H4+ 3О2 + 3×3,76N2 = 2CO2 + 2H2O + 3×3,76N2
C3H6+ 4,5О2 + 4,5×3,76N2 = 3CO2 + 3H2O + 4,5×3,76N2
C2N2+ 2О2 + 2×3,76N2 = 2CO2 + N2 + 2×3,76N2
CO + 0,5O2 = CO2
H2 + 0,5O2 = H2O
2.Определим объем продуктов горения:



Определим теоретический объем продуктов горения:

3. Определим практический объем продуктов горения по формуле:

Определим объем продуктов горения при заданной температуре:

Ответ: при сгорании газовой смеси при заданных условиях образуется 16,34 м3 продуктов горения.
 3.Определение
концентрационных пределов распространения пламени (воспламенения)
3.Определение
концентрационных пределов распространения пламени (воспламенения)
3.1 Общие положения
Концентрационные пределы распространения пламени (воспламенения) – нижний (НКПР), верхний (ВКПР). НКПР, ВКПР – минимальное (максимальное) содержание горючего вещества в однородной смеси с окислительной средой, при котором возможно распространение пламени по смеси на любое расстояние от источника зажигания.
3.2 Определение концентрационных пределов распространения пламени горючих газов и паров в воздухе
При нормальном давлении и температуре среднее расстояние между молекулами в газе приблизительно в 10 и более раз больше, чем в жидкостях и твердых телах, поэтому плотность газов значительно ниже плотности жидкостей и твердых веществ [5]. Практически все горючие газы относятся к классу легковоспламеняющихся, их горение относится к гомогенному (одинаковое агрегатное состояние) и процесс горения определяется областью воспламенения, энергией источника зажигания, температурой горения и скоростью распространения пламени.
Все смеси горючего с воздухом до точки «А» не способны воспламеняться даже от мощной электрической искры – это область безопасных концентраций. Та минимальная концентрация газов или паров, при которой смесь воспламеняется от постороннего источника зажигания с последующим распространением по всему объему смеси, называется нижним концентрационным пределом воспламенения (НКПВ).
На НКПВ смесь воздуха с горючим содержит избыток воздуха. Так, для смеси воздуха с метаном коэффициент избытка воздуха равен 2; с СО – 2,6; с Н2S – 6,9.
 При
концентрации горючего в смеси выше НКПВ горение проходит с большой скоростью,
давление при взрыве повышается вплоть до давления, соответствующего
стехиометрической концентрации веществ.
При
концентрации горючего в смеси выше НКПВ горение проходит с большой скоростью,
давление при взрыве повышается вплоть до давления, соответствующего
стехиометрической концентрации веществ.
Снижение концентрации воздуха в смесях с горючим (так называемые богатые смеси) ведет к снижению и потере способности воспламеняться. Та наивысшая концентрация горючих газов или паров в смеси, при которой смесь еще воспламеняется от постороннего источника зажигания с распространением горения по всему объему смеси, называется верхним концентрационным пределом воспламенения (ВКПВ).
Диапазон концентраций газа или пара в воздухе между НКПВ и ВКПВ называется областью воспламенения.
Концентрации горючих газов и паров с воздухом выше ВКПВ называются пожароопасными.
Знание областей безопасных и пожароопасных концентраций дает возможность в процессе применения и хранения горючих газов и жидкостей поддерживать такой режим, при котором концентрации горючего были бы выше ВКПВ или ниже НКПВ.
Области воспламенения смесей конкретных горючих газов или паров с воздухом не являются абсолютно постоянными и зависят от многих факторов (температуры смеси, давления, влажности воздуха, различных примесей, турбулентности, мощности источника зажигания и др.).
Концентрационные пределы распространения пламени могут определяться в процентах по объёму или в г/м3. Нижний концентрационный предел воспламенения φН определяют по предельной теплоте сгорания. Эмпирически установлено, что 1 м3 различных газовоздушных смесей на НКПВ выделяет при горении постоянное среднее количество тепла - 1830 кДж, называемое предельной теплотой горения. Следовательно, НКПВ определяется:

(3.1)
 Если
принять среднее значение предельной теплоты горения QПР равным 1830 кДж/м3
, то φН будет определено:
Если
принять среднее значение предельной теплоты горения QПР равным 1830 кДж/м3
, то φН будет определено:

(3.2)
где QН - низшая теплота сгорания горючего вещества, кДж/м3. Следовательно, нижний и верхний концентрационные пределы воспламенения с достаточной в инженерной практике точностью могут быть определены по аппроксимационной формуле [3, 4]:

(3.3)
где n - cтехиометрический коэффициент при кислороде в уравнении химической реакции горения; a и b - эмпирические константы, значения которых приведены в табл. 3.1.
Таблица 3.1 Значения универсальных констант
|
Концентрационные пределы воспламенения |
Значения коэффициентов |
|
|
a |
b |
|
|
Нижний |
8,684 |
4,679 |
|
Верхний n ≤ 7,5 n ˃ 7,5 |
1,550 0,768 |
0,560 6,554 |
Формулы (3.1) – (3.3) определяют величины НКПВ и ВКПВ для комнатной температуры (25 0С). В случаях, когда реакция горения происходит при иной температуре, вводятся соответствующие поправки. Если известны концентрационные пределы воспламенения при температуре 25С, то при температуре Т2 они вычисляются по формулам:

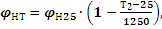 (3.4)
(3.4)

(3.5)
где φНТ и φН25 - нижний концентрационный предел воспламенения соответственно при температурах горения Т2 и комнатной (25 0С); φВТ и φВ25 - верхний концентрационный предел воспламенения соответственно при температурах горения Т2 и комнатной (250С).
3.3 Определение нижнего концентрационного предела воспламенения пылевоздушных смесей
Многие технологические процессы, связанные с получением или пере- работкой пылевидных материалов, являются пожаро- и взрывоопасными, представляют большую опасность [5]. Горючая пыль – это дисперсная система, состоящая из твердых частиц размером ≤ 850 мкм, находящихся во взвешенном или осевшем состоянии в газовой среде, способная к самостоятельному горению в воздухе. Таким образом, пыль – это дисперсная система, состоящая из газообразной дисперсионной среды и твердой дисперсной фазы. Пыли по общей классификации коллоидно-дисперсных систем относятся к аэрозолям, в которых дисперсионная среда – воздух, а дисперсная фаза – твердое вещество в мелко раздробленном состоянии.
Осевшая пыль называется аэрогелем, пыль во взвешенном состоянии – аэрозоль. И те, и другие – гетерогенные системы.
Аэрогели являются пожароопасными. Их пожароопасность зависит от содержания летучих веществ в аэрогели. При горении пыли выгорают обычно только летучие вещества, а углеродистый остаток не успевает сгореть. Так, пыль кокса, графита, антрацита и некоторых других веществ не пожароопасны, так как почти не содержат летучих компонентов. Наиболее пожароопасными являются аэрогели с температурой самовоспламенения до 250 0С.
 Аэрозоли
являются взрывоопасными. Взрывоопасность аэрозолей, со- держащих летучие
вещества, характеризуется НКПВ. Наиболее взрывоопасными являются аэрозоли с
величиной НКПВ < 15 г/м3.
Аэрозоли
являются взрывоопасными. Взрывоопасность аэрозолей, со- держащих летучие
вещества, характеризуется НКПВ. Наиболее взрывоопасными являются аэрозоли с
величиной НКПВ < 15 г/м3.
Из свойств горючих пылей наиболее важными являются: дисперсность, химическая активность, адсорбционная способность, склонность к электризации. НКПВ пылевоздушных смесей при комнатной температуре окружающей среды можно рассчитать по следующей формуле:
φн25
=К×Lн,
г/м3
(3.6)
где К – безразмерный коэффициент, зависящий от кинетических и геометрических характеристик пылевоздушных смесей; Lн – расчётная концентрация горючего вещества в воздухе, при которой адиабатическая температура горения смеси, при постоянном давлении составляет 1 550 К, г/м3.
Величина коэффициента К зависит от массовой доли влаги и иных возможных инертных добавок в пылевоздушной смеси и определяется по формуле:
К
= 0,5/(1 – γ/100)
(3.7)
где γ – массовая доля влаги и других инертных добавок в пылевоздушной смеси, %.
Расчётная концентрация горючего вещества в воздухе, при которой адиабатическая температура горения смеси, при постоянном давлении составляет 1550 К, определяется по формуле:
 (3.8)
(3.8)
где
∆Hf0 – стандартная теплота образования веществ в
твёрдом состоянии при комнатной температуре, кДж/г; hj, hs
– коэффициенты i-го элемента и s-й структурной группы, входящих в соединение и
влияющих на величину LH (табличные значения, табл. 3.2); ωi,
ωs – массовые доли i-го элемента и s-й  структурной
группы в соединении (%); Мi, Мs – молекулярные массы i-го
элемента и s-й структурной группы. Массовые доли ωi элементов,
входящих в состав пылевоздушной смеси, определяются по формуле:
структурной
группы в соединении (%); Мi, Мs – молекулярные массы i-го
элемента и s-й структурной группы. Массовые доли ωi элементов,
входящих в состав пылевоздушной смеси, определяются по формуле:

(3.9)
где ni, nc, nн, nо – количество атомов i-г=о элемента, углерода, водорода и кислорода соответственно, входящих в состаd пылевоздушной смеси; мi, мс, мн, мо – молекулярные массы i-го элемента, углерода, водорода и кислорода, входящих в состав пылевоздушной смеси.
Значения коэффициентов hj, hs i-го элемента и s-й структурной группы, входящих в соединение и влияющих на величину LH, представлены в табл. 3.2.
Таблица 3.2 Значения коэффициентов
|
hj |
hs |
|||||
|
hC |
hH |
hO |
hN |
hCl |
hc=c |
hc=o=c |
|
9,134 |
2,612 |
–0,522 |
–0,494 |
–3,57 |
7,88 |
6,50 |
Формула (3.6) определяет величину НКПВ пылевоздушной смеси для горения при комнатной температуре (25 0С). В случаях, когда реакция горения происходит при иной температуре, вводится поправка:
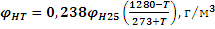 (3.10)
(3.10)
где φНТ и φН25 - нижний концентрационный предел воспламенения соответственно при температурах горения Т и комнатной (25 0С).
Задача 3.1
Определить
концентрационные пределы воспламенения метилформиата (С4Н6О2),
если экспериментально определенные значения концентрационных  пределов
распространения пламени равны (5,54 – 21,80) %, при температуре Tн =
15°C.
пределов
распространения пламени равны (5,54 – 21,80) %, при температуре Tн =
15°C.
Решение
1. Запишем уравнение реакции горения
С4Н6О2 + 4,5О2 + 4,5×3,76N2 = 4CO2 + 3H2O + 16,92N2
n = 4,5
2. В соответствии со cтехиометрическим коэффициентом при кислороде в уравнении химической реакции горения выберем в табл. 3.1 эмпирические константы a и b.
n=5; aB =1,550; bB =0,560; aH =8,684; bH =4,679
3. Определяем концентрационные пределы воспламенения:


4. Определяем погрешности расчёта концентрационных пределов воспламенения:


5. Определяем концентрационные пределы воспламенения, с учетом температуры:

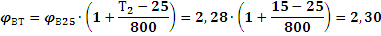
 Ответ:
нижний концентрационный предел воспламенения метилформиата равен 2,28 %,
верхний концентрационный предел воспламенения метилформиата равен 13,27 % .
Ответ:
нижний концентрационный предел воспламенения метилформиата равен 2,28 %,
верхний концентрационный предел воспламенения метилформиата равен 13,27 % .
Задача 3.2
Определить концентрационные пределы воспламенения пропана (С3Н8), если экспериментально определенные значения концентрационных пределов распространения пламени равны (2,30 – 9,40) %, при температуре Tн = 10°C.
Решение:
1. Запишем уравнение реакции горения:
С3Н8 + 5О2 + 5×3,76N2 = 3CO2 + 4H2O + 18,8N2
n = 5
2. В соответствии со cтехиометрическим коэффициентом при кислороде в уравнении химической реакции горения выберем в табл. 3.1 эмпирические константы a и b.
n=5; aB =1,550; bB =0,560; aH =8,684; bH =4,679
3. Определяем концентрационные пределы воспламенения:


4. Определяем погрешности расчёта концентрационных пределов воспламенения:


 5.
Определяем концентрационные пределы воспламенения, с учетом температуры:
5.
Определяем концентрационные пределы воспламенения, с учетом температуры:


Ответ: нижний концентрационный предел воспламенения метилформиата равен 2,08 %, верхний концентрационный предел воспламенения метилформиата равен 12,03 % .
Задача 3.3
Рассчитать нижний концентрационный предел воспламенения (НКПВ) озонина 87 (C25H30ОN2) с молярной массой 380; теплотой образования ∆Нf0 - -165,10 кДж / моль; при начальной температуре горючей смеси 00С, если определенная экспериментальная величина равна НКПВ = 20 г/м3.
Решение
1. Вычислим значение массовой доли С, Н и N соединения:




2. Принимаем величину коэффициента К = 0,5 (безразмерный коэффициент, зависящий от кинетических и геометрических характеристик аэродисперсной системы).
 3.
Переводим величину стандартного образования озонина 87 в необходимую
размерность:
3.
Переводим величину стандартного образования озонина 87 в необходимую
размерность:

4. Определяем концентрацию горючего вещества в воздухе соответствующую адиабатной температуре горения cмеси:

5. Рассчитываем нижний концентрационный предел воспламенения (НКПВ):
φн1 =К×Lн = 0,5×50,74 = 25,37 г/м3
6. Рассчитываем нижний концентрационный предел воспламенения (НКПВ) для заданной температуры:

7. Находим погрешность:

Ответ: нижний концентрационный предел воспламенения (НКПВ) озонина 87, при начальной температуре горючей смеси 0°C, равен 28,31 г/м3.
 4.
Определение состава и расчет объема продуктов взрывчатого разложения
4.
Определение состава и расчет объема продуктов взрывчатого разложения
4.1. Общие положения
Взрыв – это освобождение большого количества энергии в ограничен- ном объеме за короткий промежуток времени [5].
Взрыв приводит к образованию сильно нагретого газа (плазмы) с очень высоким давлением, который при моментальном расширении оказывает ударное механическое воздействие (давление, разрушение) на окружащие тела.
Взрыв в твердой среде сопровождается ее разрушением и дроблением, в воздушной или водной – вызывает образование воздушной или гидравлической ударных волн, которые и оказывают разрушающее воздействие на помещенные в них объекты.
В деятельности, не связанной с преднамеренными взрывами в условиях промышленного производства, под взрывом следует понимать быстрое, неуправляемое высвобождение энергии, которое вызывает ударную волну, движущуюся на некотором удалении от источника.
Взрыв в твердой среде вызывает ее дробление и разрушение, в гидравлической и воздушной среде – вызывает образование гидравлической и воздушной ударной (взрывной) волны.
Посредством взрывной волны (или разлетающихся продуктов взрыва - в вакууме) взрыв производит механическое воздействие на объекты, находящиеся на различных удалениях от места взрыва. Таким образом, взрыв несет потенциальную опасность поражения людей и обладает разрушительной способностью.
Взрывчатые вещества (ВВ) – химические соединения или смеси веществ, способные к быстрому, самораспространяющемуся превращению, с выделением большого количества тепла и образованием газообразных продуктов.
Количество энергии, выделяющейся
при взрыве ВВ относительно невелико. Даже при взрыве самого мощного ВВ (помимо
атомных и термоядерных взрывов)  выделяется
в 5–6 раз меньше тепла, чем при сгорании на воздухе равного количества нефти.
Однако, концентрация энергии во взрывчатом веществе очень велика.
выделяется
в 5–6 раз меньше тепла, чем при сгорании на воздухе равного количества нефти.
Однако, концентрация энергии во взрывчатом веществе очень велика.
По составу ВВ разделяют на две большие группы: индивидуальные со- единения и смеси.
К индивидуальным ВВ относят химические соединения, у которых при внешних воздействиях происходит разрыв химических связей в молекулах с последующей рекомбинацией атомов в конечные продукты взрыва (ПВ), в результате чего горючие элементы соединяются с окислительными. Индивидуальные ВВ преимущественно являются органическими соединениями, содержащими одну или более групп NO2.
Взрывчатые смеси – представляют собой композиции, состоящие, по крайней мере, из двух химически не связанных между собой веществ. Обычно один из компонентов относительно богат кислородом, а во втором, либо кислорода недостаточно для внутримолекулярного окисления, либо вовсе нет (углеводы, металлы – алюминий, магний). Взрывчатые смеси часто готовят из соединений, способных окислятся (горючих), и веществ, содержащих значительные количества окислителей (кислорода). При взрывчатом превращении элементы горючего окисляются за счет кислорода, содержащегося в окислителе. В качестве компонентов смесей применяют как ВВ, так и вещества, которые сами по себе невзрывчатые.
4.2Химические реакции взрывных превращений
Конечный итог реакций взрывного превращения выражают обычно уравнением, связывающим химическую формулу исходного ВВ или состав его (в случае взрывчатой смеси) с составом конечных продуктов взрыва.
Знание уравнения химического
превращения при взрыве существенно в двух отношениях. С одной стороны, по этому
уравнению можно рассчитать теплоту и объем газообразных продуктов взрыва, а
следовательно, и температуру, давление и другие его параметры. С другой
стороны, состав продуктов взрыва  получает
особое значение, если речь идет о ВВ, предназначенных для взрывных работ в
подземных выработках (отсюда – расчет рудничной вентиляции, чтобы количество
окиси углерода и окислов азота не превосходило определенного объема).
получает
особое значение, если речь идет о ВВ, предназначенных для взрывных работ в
подземных выработках (отсюда – расчет рудничной вентиляции, чтобы количество
окиси углерода и окислов азота не превосходило определенного объема).
Однако при взрыве не всегда устанавливается химическое равновесие. В тех многочисленных случаях, когда расчет не позволяет надежно установить итоговое равновесие взрывного превращения, – обращаются к эксперименту. Но экспериментальное определение состава продуктов в момент взрыва также встречает серьезные трудности, так как в продуктах взрыва при высокой температуре могут содержаться атомы и свободные радикалы (активные частицы), обнаружить которые после охлаждения не удается.
Органические ВВ, как правило, состоят из углерода, водорода, кислорода и азота. Следовательно, в продуктах взрыва могут содержаться следующие газообразные и твердые вещества: СО2, Н2О, N2, CO, O2, H2, CH4 и другие углеводороды: NH3, C2N2, HCN, NO, N2O, C. Если в состав ВВ входят сера или хлор, то в продуктах взрыва могут содержаться соответственно SO2, H2S, HCl и Cl2.
В случае содержания в составе ВВ металлов, например, алюминия или некоторых солей (например, нитрата аммония NH4NO3, нитрата бария Ba(NO3)2; хлоратов – хлората бария Ba(ClO3)2, хлората калия КСlO3; перхлоратов – аммония NHClO4 и др.) в составе продуктов взрыва встречаются оксиды, например Al2O3, карбонаты, например, карбонат бария ВаСО3, карбонат калия К2СО3, бикарбонаты (КНСО3), цианиды (KCN), сульфаты (BaSO4, K2SO4), сульфиды (NS, K2S), сульфиты (K2S2O3), хлориды (AlCl3, BaCl2, KCl) и другие соединения. Наличие и количество тех или иных продуктов взрыва в первую очередь зависит от кислородного баланса состава ВВ.
Кислородный баланс характеризует соотношение между содержанием во взрывчатом веществе горючих элементов и кислорода [3, 5].
 Вычисляют
кислородный баланс обычно как разность между весовым количеством кислорода,
содержащегося во ВВ, и количеством кислорода, потребным для полного окисления
горючих элементов, входящих в его состав. Расчет ведут на 100 г ВВ, в
соответствии, с чем кислородный баланс выражают в процентах. Обеспеченность
состава кислородом характеризуется кислородным балансом (КБ) или кислородным
коэффициентом αК, которые в
относительных величинах выражают избыток или недостаток кислорода для полного
окисления горючих элементов до высших оксидов, например, СО2 и Н2О.
Вычисляют
кислородный баланс обычно как разность между весовым количеством кислорода,
содержащегося во ВВ, и количеством кислорода, потребным для полного окисления
горючих элементов, входящих в его состав. Расчет ведут на 100 г ВВ, в
соответствии, с чем кислородный баланс выражают в процентах. Обеспеченность
состава кислородом характеризуется кислородным балансом (КБ) или кислородным
коэффициентом αК, которые в
относительных величинах выражают избыток или недостаток кислорода для полного
окисления горючих элементов до высших оксидов, например, СО2 и Н2О.
Если ВВ содержит как раз столько кислорода, сколько нужно для полного окисления входящих в его состав горючих элементов, то кислородный баланс его равен нулю. Если избыток – КБ положителен, при недостатке кислорода – КБ отрицателен. Сбалансированность ВВ по кислороду соответствует КБ – 0; αК = 1.
Если ВВ содержит углерод, водород, азот и кислород и описывается уравнением СаHbNcOd, то величины кислородного баланса и кислородного коэффициента могут определяться по формулам:
 (4.1)
(4.1)

(4.2)
где а, b, c и d – число атомов соответственно С, H, N и О в химической формуле ВВ; 12, 1, 14, 16 – округленные до целого числа атомные массы соответственно углерода, водорода, азота и кислорода; знаменатель дроби в уравнении (4.1) определяет молекулярную массу ВВ:
М = 12а + в + 14с + 16d
С точки зрения безопасности производства и эксплуатации (хранения, транспортирования, применения) ВВ большинство их рецептур имеют отрицательный кислородный баланс. По кислородному балансу все ВВ подразделяются на следующие три группы:
- I группа – ВВ с положительным кислородным балансом: углерод окисляется до СО2, водород до Н2О, азот и избыток кислорода выделяются в элементарном виде.
-
 II
группа – ВВ с отрицательным кислородным балансом, когда кислорода недостаточно
для полного окисления компонентов до высших оксидов и углерод частично
окисляется до СО (но все ВВ превращаются в газы).
II
группа – ВВ с отрицательным кислородным балансом, когда кислорода недостаточно
для полного окисления компонентов до высших оксидов и углерод частично
окисляется до СО (но все ВВ превращаются в газы).
- III группа – ВВ с отрицательным кислородным балансом, но кислорода недостаточно для превращения всех горючих компонентов в газы (в продуктах взрыва имеется элементарный углерод).
4.3.4. Определение объема продуктов взрывчатого разложения
Газообразные продукты взрыва являются тем непосредственным агентом, при помощи которого выделяющаяся энергия превращается в работу. Наряду с этим знание объема и состава газообразных продуктов взрыва позволяет рассчитать максимальную температуру, которая могла быть достигнута при этом.
Объем продуктов взрыва одного килограмма ВВ определяется по формуле:
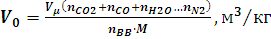 (4.3)
(4.3)
где Vμ = 22,4 м3/кмоль – объем/киломоля газов (при 00С и 101325 Па); nCO2 + nCO + nH2O…nN2 и nвв – число к/молей диоксида углерода, оксида углерода, паров воды, других газообразных компонентов продуктов взрыва, азота и исходного ВВ в уравнении реакции взрывчатого разложения.
Задача 4.1
Вычислить объем газообразных продуктов взрыва 1 кг мононитротолуола С7Н7NO2. КБ = -181,0%, М = 137.
Решение:
1. Запишем уравнение реакции взрывчатого разложения:
С7 Н7NO2 = 2Н2О + 1,5Н2 + 7С + 0,5N2
Вторичные реакции:
Н2О + СО = СО2 + Н2
2СО = CO2 + C
 2.
Определяем объём продуктов взрывчатого разложения:
2.
Определяем объём продуктов взрывчатого разложения:

Ответ: объём продуктов взрывчатого разложения мононитротолуола равен 0,82 м3/кг
Задача 4.2
Определить состав и объём продуктов взрывчатого разложения 1 кг сплава ТГ с алюминием составом: гексоген (C3H6N6O6) – 70%; тротил (C7H5N3O6) – 20%, алюминий (Al) – 10 %. М(C3H6N6O6) = 222, М(C7H5N3O6) = 227, М(Al) = 27.
Решение:
1.Запишем уравнение взрывчатого разложения:
200/227 C7H5N3O6 + 700/222 C3H6N6O6 + 100/27 Al = C15,61H23,3N21,54O24,18Al3,70 = 11,65 Н2О + 6,98 СО + 8,63C + 1,85Al2O3 + 10,77N2
2.Определяем объём продуктов взрывчатого разложения:

Ответ: объём продуктов взрывчатого разложения сплава ТГ с алюминием равен 0,66 м3/кг.
5. Теплота и температура взрыва
5.1. Общие положения
Механическую работу
взрыва производят расширяющиеся газообразные продукты взрывчатого превращения,
нагретые до высокой температуры за счет теплоты, выделившейся при этом
превращении. Теплота взрыва, а также объем  образовавшихся
газов позволяют оценить возможную работоспособность (фугасное действие) ВВ.
Знание теплоты взрыва с учетом плотности ВВ и скорости детонации позволяет
судить о разрушающем действии взрыва на среду в непосредственной близости от
заряда (бризантное действие).
образовавшихся
газов позволяют оценить возможную работоспособность (фугасное действие) ВВ.
Знание теплоты взрыва с учетом плотности ВВ и скорости детонации позволяет
судить о разрушающем действии взрыва на среду в непосредственной близости от
заряда (бризантное действие).
Для количественной характеристики метательного, дробящего, теплового и других видов действия необходимо знать теплоту взрыва, температуру и давление его продуктов.
5.2. Расчет теплоты взрыва
Теплота (количество тепла) – внутренняя энергия системы, которая самопроизвольно переходит от тел более нагретых, к телам, менее нагретым путем теплопроводности или теплоизлучения.
Теплота взрыва – количество тепловой энергии, выделяющейся при взрывном превращении (горении или детонации) определенной массы ВВ. В технике за единицу массы при расчетах теплоты взрыва принимают 1 кг. Размерность теплоты взрыва кДж/кг. Для определения теплоты взрыва применяются два метода: расчетный и экспериментальный.
Теплоту взрыва рассчитывают на основе закона Гесса, согласно которому «тепловой эффект химического превращения системы зависит только от начального и конечного ее состояния и не зависит от промежуточных состояний, т.е. от пути перехода». На основании этого закона выделившаяся при взрыве теплота равна разности теплот образования исходного вещества и конечных продуктов [5]:
Qv
= Q1 – Q2
(5.1)
где Q1 – сумма теплот образования продуктов взрыва; Q2 – теплота образования ВВ.
При расчетах теплоты взрыва применяют несколько методов.
5.2.1. Основной метод определения теплоты взрыва индивидуальных ВВ
При вычислении теплоты взрыва по этому методу используют следующие исходные данные:
-
 теплоты
образования ВВ;
теплоты
образования ВВ;
- теплоты образования продуктов взрыва;
- уравнение реакции взрывчатого разложения.
Теплота взрыва 1 кг ВВ определяется по формуле:
 (5.2)
(5.2)
где nj – число молей j-го продукта взрывчатого разложения в уравнении реакции; Qvj – теплота образования j-го продукта взрывчатого разложения при постоянном объеме, кДж/моль; Qvвв – теплота образования ВВ при постоянном объеме, кг/моль; М – масса ВВ, численно равная его молярной массе, кг/моль.
Пересчет Qр в Qv осуществляется по формуле:
Qv = Qр + q = Qр + 0,58 · n, ккал/моль (5.3)
где 0,58 – множитель, представляющий собой выраженную в ккал работу расширения 1 моль газов при их нагревании от 0 до 18 °С, связанного с изменением объема при постоянном давлении равном 101 325 Па; n – число молей ВВ и газообразных продуктов соответственно.
5.2.2. Определение теплоты взрыва методом Г.А. Авакяна
Данный метод позволяет рассчитать теплоту взрыва индивидуальных веществ, не прибегая к написанию уравнения реакции взрывчатого разложения [6]. В основе метода лежит гипотеза о том, что суммарная теплота образования продуктов взрыва есть однозначная функция кислородного коэффициента ВВ:

(5.4)
где а, b и d – число атомов соответственно углерода, водорода и кислорода, входящих в ВВ (условная формула СаНbNcOd).
Теплота взрыва по этому методу определяется по формулам:
Qv = К(94а + 28,7b) – Qвв, ккал/моль при αк ≥ 100%; (5.5)
 Qv
= К(47d + 5,25b) – Qвв, ккал/моль при αк <
100%, (5.6)
Qv
= К(47d + 5,25b) – Qвв, ккал/моль при αк <
100%, (5.6)
где К = 0,32; αк = 0,24 – «коэффициент реализации», согласующий результаты расчета с экспериментальными данными.
5.2.3. Метод ориентировочного определения теплоты взрыва смесевых ВВ
Для грубой оценки теплоты взрыва QV cмесевых веществ можно воспользоваться правилом аддитивности (значение величины целого равно сумме величин частей), полагая, что каждый компонент вносит вклад в те- плоту взрыва пропорционально своему содержанию в смеси [6]:
 (5.7)
(5.7)
где vi и QVi – массовая доля и теплота взрыва i-го компонента в смеси.
5.2.4. Уточненный метод расчета теплоты взрыва смесевых ВВ
Последовательность определения:
- составляется условная формула 1 кг смесевого ВВ, СаНbNсOd с ис- пользованием соотношений:

где nj – мольная доля j-го компонента смеси;
- составляется уравнение реакции;
- вычисляется молекулярная масса смеси;
- рассчитывается кислородный коэффициент αк (как по методу Авакяна);
- определяется теплота образования 1 моля смеси по формуле:

(5.8)
-
 определяется
теплота взрыва 1 кг смесевого ВВ (по формуле основного метода определения
теплоты взрыва индивидуальных ВВ) или (по формуле метода Авакяна).
определяется
теплота взрыва 1 кг смесевого ВВ (по формуле основного метода определения
теплоты взрыва индивидуальных ВВ) или (по формуле метода Авакяна).
5.3. Температура продуктов взрыва
Основными термодинамическими характеристиками продуктов взрыва являются удельный объем V, температура Т и давление Р [5]. Они связаны общим уравнением состояния (уравнение Менделеева-Клайперона для идеальных газов):
РV
= nR·T
(5.9)
где n – количество молей газообразных продуктов взрыва; R – универсальная газовая постоянная, R = 8,314 Дж/моль·К.
Температура – один из основных термодинамических параметров, определяющих тепловое состояние вещества, тела, системы тел. Согласно молекулярно-кинетической теории, температура системы прямо пропорциональна средней кинетической энергии теплового движения частиц.
Передача тепла от одного тела к другому может происходить только при наличии разности температур (от более нагретого к менее нагретому). Для измерения температуры применяют следующие температурные шкалы:
- абсолютную термодинамическую;
- международную практическую.
Единицей измерения по абсолютной термодинамической шкале является кельвин (К), а по международной практической – градус Цельсия (°С).
Соотношение в градусах: T = t + 273, К; t = Т – 273,°С.
Под температурой взрыва понимают наибольшее значение температуры, до которого нагреваются продукты взрывчатого разложения. В основе вычисления этой температуры заложено предположение, что взрывчатое превращение – адиабатический процесс (система не обменивается теплотой с окружающей средой), протекающий при постоянном объеме и, таким образом, выделяющееся в процессе взрыва тепло расходуется только на нагрев продуктов взрыва. На основании изложенного теплота взрыва при постоянном объеме определяется по формуле:

 (5.10)
(5.10)
где СV – суммарная молярная теплоемкость всех продуктов взрыва в интервале температур от нуля до температуры взрыва, кал/моль·град.; tпв – температура продуктов взрыва, °С.
Теплоемкость СV является функцией температуры, ее можно определить по формуле Малляра и Ле Шателье (для температур более 1000 °С):
СV = a + btпв, кал/моль·град (5.11)
Тогда теплота взрыва определится выражением:
 (5.12)
(5.12)
Отсюда
 (5.13)
(5.13)
Значения теплоемкостей 1 моля продуктов взрыва можно определить, используя следующие выражения, кал/моль·град:
- для двухатомных газов (СО, N2) СV = 4,8 + 4,5 · 10–4 tпв;
- для воды СV = 4,0 + 21,5 · 10–4 tпв;
- для диоксида углерода СV = 9,0 + 5,8 · 10–4 tпв;
- для четырехатомных газов СV = 10 + 4,5 · 10–4 tпв;
- для пятиатомных газов СV = 12 + 4,5 · 10–4 tпв;
- для твердых продуктов взрыва СV = 6,4.
Задача 5.1
 Определить
теплоту взрыва 1 кг мононитротолуола С7Н7NO2.
М = 137, теплота образования Qр = 10,7 ккал/моль.
Определить
теплоту взрыва 1 кг мононитротолуола С7Н7NO2.
М = 137, теплота образования Qр = 10,7 ккал/моль.
Решение
1. Пишем уравнение реакции взрывчатого разложения:
С7 Н7NO2 = 2Н2О + 1,5Н2 + 7С + 0,5N2
Вторичные реакции:
Н2О + СО = СО2 + Н2
2СО = CO2 + C
Величины теплот образования продуктов разложения:
- вода (газ) Н2О – 57,78ккал/моль;
2. Вычисляем суммарную теплоту образования продуктов взрыва при постоянном давлении:

3. Произведем пересчет Qр в Qv ВВ (мононитротолуола):




4. Рассчитываем теплоту взрыва 1 кг мононитротолуола:

Задача 5.2
Определить теплоту взрыва 1 кг мононитротолуола С7Н7NO2. М = 137, теплота образования Qр = 10,7 ккал/моль.
Решение:
 1.
Определяем αк (кислородный коэффициент):
1.
Определяем αк (кислородный коэффициент):

2. Производим пересчет QP в QV:

3. Вычисляем теплоту взрыва 1 моля мононитротолуола:
Qvм = К×(47d + 5,25b) – Qвв = 0,32×11,40,24 (47×2 + 5,25×7) - 11,28 = 63,6 ккал/моль
4. Рассчитываем теплоту взрыва 1 кг мононитротолуола в размерности СИ:

Задача 5.3
Определить теплоту продуктов взрывчатого разложения 1 кг сплава ТГ с алюминием составом: гексоген (C3H6N6O6) – 70%; тротил (C7H5N3O6) – 20%, алюминий (Al) – 10 %. М(C3H6N6O6) = 222, М(C7H5N3O6) = 227, М(Al) = 27; QV (тротил) – 1000 ккал/кг, QV (гексоген) – 1320 ккал/кг.
Решение:
Теплота взрыва смесевого ВВ определяется по формуле:

где Vi – дольное содержание компонента; QVi – теплота образования от- дельного компонента.
QV = 0,2×1000 + 0,7 × 1320 = 1124 ккал/кг
Переведем в кДж/кг:
 QV
=
4,19 ×
1124 кДж/кг
QV
=
4,19 ×
1124 кДж/кг
Задача 5.4
Определить теплоту продуктов взрывчатого разложения 1 кг сплава ТГ с алюминием составом: гексоген (C3H6N6O6) – 70%; тротил (C7H5N3O6) – 20%, алюминий (Al) – 10 %. М(C3H6N6O6) = 222, М(C7H5N3O6) = 227, М(Al) = 27.
Решение:
1.Запишем уравнение взрывчатого разложения:
200/227 C7H5N3O6 + 700/222 C3H6N6O6 + 100/27 Al = C15,61H23,3N21,54O24,18Al3,70 = 11,65 Н2О + 6,98 СО + 8,63C + 1,85Al2O3 + 10,77N2
2. Молярная масса амматола равна 998,96 ккал/моль.
3. Определяем αк (кислородный коэффициент):

4. Вычисляем теплоту образования 1 моля смеси:


Qvм = К×(47d + 5,25b) – Qвв = 0,32 × 49,90,24 (47×24,18 + 5,25×23,3) – (-31,56) = 1057,05 ккал/моль
Переведем в кДж/кг:

Задача 5.5
 Определить
теплоту продуктов взрывчатого разложения 1 кг сплава ТГ с алюминием составом:
гексоген (C3H6N6O6) – 70%; тротил
(C7H5N3O6) – 20%, алюминий (Al)
– 10 %. М(C3H6N6O6) = 222, М(C7H5N3O6)
= 227, М(Al) = 27.
Определить
теплоту продуктов взрывчатого разложения 1 кг сплава ТГ с алюминием составом:
гексоген (C3H6N6O6) – 70%; тротил
(C7H5N3O6) – 20%, алюминий (Al)
– 10 %. М(C3H6N6O6) = 222, М(C7H5N3O6)
= 227, М(Al) = 27.
Решение:
1.Запишем уравнение взрывчатого разложения:
200/227 C7H5N3O6 + 700/222 C3H6N6O6 + 100/27 Al = C15,61H23,3N21,54O24,18Al3,70 = 11,65 Н2О + 6,98 СО + 8,63C + 1,85Al2O3 + 10,77N2
2. Молярная масса амматола равна 998,96 ккал/моль.
3. Вычисляем суммарную теплоту образования продуктов взрыва при постоянном давлении:




Переведем ккал/моль в кДж/кг:

 6.
Расчёт температуры продуктов взрыва
6.
Расчёт температуры продуктов взрыва
Задача 6.1
Определить температуру продуктов взрыва мононитротолуола.
Уравнение реакции взрыва мононитротолуола:
С7 Н7NO2 = 2Н2О + 1,5Н2 + 7С + 0,5N2
Теплота взрыва 1 моля мононитротолуола:

Решение
1. Записываем уравнения для расчета молярных теплоемкостей продуктов взрыва и вычисляем их суммарную теплоемкость:
СV = a + btпв, кал/моль·град
СVн2о = 2·(4,0+0,00215· tпв.) = 8,0 + 0,0043 tпв.
СVн2 = 1,5·(4,8+0,00045· tпв.) = 7,2 + 0,00169· tпв
СVс = 7·6,4 = 44,8
СVN2 = 0,5·(4,8+0,00045· tпв.) = 2,4+0,000225· tпв.
Суммарная молярная теплоемкость составляет:25,11
CV = 62,4 + 0,0062· tпв.
2. Определяем температуру продуктов взрыва мононитротолуола:

Абсолютная температура продуктов взрыва мононитротолуола:
tпв = 2000 + 273 = 2273 K
Задача 6.2
 Определить
температуру продуктов взрывчатого разложения смеси составом: гексоген (C3H6N6O6)
– 70%; тротил (C7H5N3O6) – 20%,
алюминий (Al) – 10 %. М(C3H6N6O6)
= 222, М(C7H5N3O6) = 227, М(Al)
= 27.
Определить
температуру продуктов взрывчатого разложения смеси составом: гексоген (C3H6N6O6)
– 70%; тротил (C7H5N3O6) – 20%,
алюминий (Al) – 10 %. М(C3H6N6O6)
= 222, М(C7H5N3O6) = 227, М(Al)
= 27.
Решение:
1. Уравнение реакции взрывчатого разложения:
200/227 C7H5N3O6 + 700/222 C3H6N6O6 + 100/27 Al = C15,61H23,3N21,54O24,18Al3,70 = 11,65 Н2О + 6,98 СО + 8,63C + 1,85Al2O3 + 10,77N2
Теплота взрыва 1 моля смеси:

Решение
1. Записываем уравнения для расчета молярных теплоемкостей продуктов взрыва и вычисляем их суммарную теплоемкость:
СV = a + btпв, кал/моль·град
СVн2о = 11,65·(4,0+0,00215· tпв.) = 46,56 + 0,0250 tпв.
СVсо = 6,98·(4,8+0,00045· tпв.) = 33,5 + 0,003141 tпв.
СVс = 8,63·6,4 = 55,232
СVal2o3=1,85·6,4=11,84
СVN2 = 10,77·(4,8+0,00045· tпв.) = 51,696+0,00485· tпв.
Суммарная молярная теплоемкость составляет:
CV = 198,8 + 0,0330· tпв.
2. Определяем температуру продуктов взрыва:

Абсолютная температура продуктов взрыва:
tпв = 4658,6 + 273 = 4931,6 K
7. ДАВЛЕНИЕ ПРОДУКТОВ ВЗРЫВА
 7.1.
Общие положения
7.1.
Общие положения
Давление (Р) – физическая величина, характеризующая интенсивность сил, действующих на элемент поверхности тела нормально к этой поверхности.
При равномерном распределении силы F на поверхности площадью S давление выражается формулой:

(7.1)
Эта единица называется паскалем (Па) 1Па = 1Н/м2.
В технической термодинамике различают давление:
- атмосферное (барометрическое);
- избыточное (манометрическое);
- вакууметрическое;
- абсолютное.
Атмосферным называется гидростатическое давление, оказываемое атмосферой на все имеющиеся в ней предметы. Для измерения атмосферного давления применяют ртутные и металлические барометры, измеряющие давление в миллиметрах ртутного или водяного столба.
Избыточное, сверхбарометрическое давление не является параметром состояния газа и в зависимости от давления окружающей среды может принимать различные значения для одного и того же газа. Избыточное давление измеряют специальными приборами – манометрами.
Вакууметрическое давление (разряжение) – разность между атмосферным и абсолютным давлением меньше атмосферного (измеряется вакууметрами).
Под абсолютным давлением подразумевается полное давление, под которым находится газ (сумма избыточного давления и давления окружающей среды).
Давление горения – давление, создаваемое газообразными продуктами горения ВВ в частично или полностью замкнутой оболочке.
 Давление
продуктов взрыва РВЗР – максимальное давление продуктов взрывчатого
разложения в объеме самого ВВ, отвечающее как бы мгновенному взрыву всей его
массы перед началом расширения продуктов взрыва. Давление продуктов взрыва
является энергетической характеристикой, по которой сравнивают
работоспособность различных ВВ. Чем больше величина РВЗР при прочих
равных условиях, тем большую работу может совершить данное ВВ. Давление
продуктов взрыва единицы массы ВВ можно определить аналитическим расчетом или
экспериментально.
Давление
продуктов взрыва РВЗР – максимальное давление продуктов взрывчатого
разложения в объеме самого ВВ, отвечающее как бы мгновенному взрыву всей его
массы перед началом расширения продуктов взрыва. Давление продуктов взрыва
является энергетической характеристикой, по которой сравнивают
работоспособность различных ВВ. Чем больше величина РВЗР при прочих
равных условиях, тем большую работу может совершить данное ВВ. Давление
продуктов взрыва единицы массы ВВ можно определить аналитическим расчетом или
экспериментально.
7.2. Расчет величины давления продуктов взрыва
В практике инженерных расчетов величины РВЗР используется уравнение состояния реального газа Ван-Дер-Ваальса [5]:
(Р + b) ( V – a) = nRT, (7.2)
где Р = РВЗР – давление продуктов взрыва, Па; b – приращение давления за счет сил взаимодействия между молекулами, уменьшающееся с увеличением температуры; в рассматриваемом случае (для взрыва) температура газообразных продуктов высока, поэтому величиной b пренебрегают, т. е. b = 0; V – объем, занимаемый продуктами взрыва, подсчитанный по заданной плотности заряда ВВ РВВ по формуле:

(7.3)
где R – газовая постоянная, R = 8,34 Дж/моль×К; α – коволюм (объем газов, сжатых до плотности твердого вещества при взрыве); его величина тем больше, чем выше давление продуктов взрыва:
a
= 0,001×
V0, м3,
(7.4)
где V0 – объем продуктов взрывчатого разложения,

 (7.5)
(7.5)
где Vm = 22,4 м3/кмоль, nCO … – число молей соответствующих газообразных продуктов взрывчатого разложения.
Число молей газообразных продуктов взрывчатого разложения 1 кг ВВ определяется по формуле:
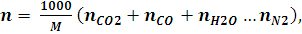 (7.6)
(7.6)
где nH2O, nCO2, nCO,…nN2 – число молей всех газообразных компонентов продуктов взрывчатого разложения.
При отрицательном КБ ВВ взрывчатое разложение сопровождается образованием конденсированных частиц, например, углерода. Кроме того, в смесевых ВВ часто присутствуют металлические добавки, например, Al, образующие при взрыве конденсированные частицы окислов металлов. Объем, занимаемый этими частицами αк так же необходимо учитывать. Удельные объемы некоторых твердых веществ при давлении и температуре взрыва следующие, м3/кг:
- углероде аморфный С – 0,008;
- оксид алюминия Al2O3 – 0,026 ·10–3.
Величину αк можно определить по формуле:

(7.7)
где Mk nk – атомная (молекулярная) масса и число молей вещества, образующего конденсированные частицы; Рk – плотность конденсированных частиц, кг/м3, углерода С – 2250; оксида алюминия Al2O3 – 4000.
С учетом изложенного, уравнение по расчету давления продуктов взрыва примет вид:
РВЗР(V – α – αк) = nRTВЗР (6.8)
Отсюда максимальное давление продуктов взрыва 1 кг ВВ определится по следующей формуле:

(7.9)
Задача 7.1
Определить давление продуктов взрыва 1 кг мононитротолуола С7H7NO2, M = 137, rВВ = 1000 кг/м3. Уравнение реакции: С7 Н7NO2 = 2Н2О + 1,5Н2 + 7С + 0,5N2. Температура взрыва ТВЗР = 2025 К, начальный объем продуктов взрыва V0 = 0,41 м3/кг.
 Решение
Решение
1. Вычислим объем продуктов взрыва 1 кг ВВ по заданной плотности заряда:

2. Определим число молей газообразных продуктов взрывчатого разложения 1 кг мононитротолуола:

3. Вычисляем коволюм продуктов взрывчатого разложения:

4. Определяем объем, занимаемый конденсированными частицами (углеродом):

5. Рассчитываем давление продуктов взрыва 1 кг мононитротолуола:

Задача 7.2
Определить давление продуктов взрыва сплава ТГ с алюминием, составом: : гексоген (C3H6N6O6) – 70%; тротил (C7H5N3O6) – 20%, алюминий (Al) – 10 %. М(C3H6N6O6) = 222, М(C7H5N3O6) = 227, М(Al) = 27. V0 = 0,66 м3 /кг ; Твзр = 4931,6 К; MВВ= 998,96 ; ρВВ = 1000 кг/м3
Решение:
Уравнение реакции взрывчатого разложения:
200/227 C7H5N3O6 + 700/222 C3H6N6O6 + 100/27 Al = C15,61H23,3N21,54O24,18Al3,70 = 11,65 Н2О + 6,98 СО + 8,63C + 1,85Al2O3 + 10,77N2
1. Вычислим объем продуктов взрыва 1 кг ВВ по заданной плотности заряда:

 2.
Определим число молей газообразных продуктов взрывчатого разложения 1 кг
сплава:
2.
Определим число молей газообразных продуктов взрывчатого разложения 1 кг
сплава:

3. Вычисляем коволюм продуктов взрывчатого разложения:

4. Определяем объем, занимаемый конденсированными частицами (углеродом):

5. Рассчитываем давление продуктов взрыва 1 кг сплава ТГ с алюминием:

 Список использованной литературы
Список использованной литературы
1. Демидов, П.Г. Горение и свойства горючих веществ / П.Г. Демидов, В.А. Шандыба, П.П. Щеглов. – 2-е изд., перераб. – М.: Химия, 1981. – 248 с.
2. Пожарная безопасность. Взрывобезопасность: справочное издание /А.Н. Баратов, Е.Н. Щеглов, А.Я. Корольченко и др. – М.: Химия, 1987. – 272 с.
3. Голотин, Г.И. Теория горения и взрыва: учебное пособие к практическим занятиям / Г.И. Голотин, И.В. Зубанова; под ред. А.И. Сидорова. – Челябинск: Изд-во ЮУрГУ, 2000. – Ч. I.– 82 с.
4. Андросов, А.С. Примеры и задачи по курсу «Теория горения и взры ва»: учебное пособие / А.С. Андросов, Е.П. Салеев. – М.: Академия ГПС МЧС России, 2008. – 80 с.
5. Зеленкин, В.Г. Теория горения и взрыва: конспект лекций / В.Г. Зеленкин, С.И. Боровик, М.Ю. Бабкин. – Челябинск: Изд-во ЮУрГУ, 2011. – 166 с.
6. Физика взрыва: монография / под ред. К.П. Станюковича. – 2-е изд., перераб. – М.: Наука, 1975. – 704 с.
7. Андреев, К.К. Теория взрывчатых веществ: учебник для химико- технологических специальностей вузов / К.К. Андреев, А.Ф. Беляев. – М.: Оборонгиз, 1960. – 560 с.














 (zip - application/zip)
(zip - application/zip)