1.Қатты күйге анықтама беріңіз
және құрылымы бойынша салыстыру
жасаңыз.
2.Кристалдық
және аморфтық заттарға анықтама
беріңіз.
3.Симметрия элементтері және симметрия операциялары
ұғымдарына анықтама
беріңіз.
4.Кристалдық тор және элементар ұяшық ұғымдарын
түсіндіріңіз.
5.Элементар ұяшық,базис,қарапайым
және күрделі ұяшықтарға анықтама
беріңіз.
6.Кристалдық
түйіндер, кристалдық бағыттарға
анықтама беріңіз.
7.Кристалдық
жазықтықтар жәнеМиллер индекстеріне анықтама
беріп,жазықтықтар координаттары
қалай анықталатынын түсіндіріңіз.
8.Кері кеңістік пен оң кеңістіктің байланысын
көрсетіңіз.
9.Кері кеңстік,кері тор векторы
және оны анықтайтын формулаларды
көрсетіңіз.
10.Материалдардың механикалық қасиеттеріне,соның ішнде
беріктілікке анықтама беріңіз.
11.Материалдардың механикалық қасиеттеріне, соның ішінде
қаттылыққа анықтама беріңіз.
12.Материалдардың механикалық қасиеттеріне, Юнг модуліне анықтама
беріңіз.
14.Деформация ұғымына анықтама беріңіз
және түрлерін көрсетіңіз.
15.Созылу диаграммасын сызыңыз
және талдаңыз.
16.Деформация механизмін түсіндіріңіз жəне
пластикалық деформацияға анықтама беріңіз.
17.
Кристалдық тордағы ақаулар, соның
ішінде нүктелік ақауға анықтама
беріңіз.
18. Кристалдық
тордағы ақаулар, соның ішінде сызықтық
ақауға анықтама беріңіз.
19. Нүктелік ақаулар, Френкель және Шотки бойынша ақауларды
түсіндіріңіз.
20.Кристалдық тордағы ақаулар, дислокация және Бюргерс векторы ұғымдарын
түсіндіріңіз.
21. Деформация механизмін түсіндіріңіз және серпімді деформацияға
анықтама беріңіз.
22. Материалдардың электірлік қасиеттері және өткізгіш,
жартылай өткізгіш, диэлектрик болып бөлінуін түсіндіріңіз.
23. Аумақтық теория негізінде
материалдардың электірлік қасиеттерін түсіндіріңіз.
24 Диэлектриктердің поляризациясы және поляризация
түрлеріне тоқталып,поляризация
механизмін түсіндіріңіз.
25. Материалдардың магнитік
қасиеттерін талдап, гистерезис
тұзағын(петля) тұрғызыңыз.
26. Химиялық байланыстар,
соның ішіндековалентті байланысты
түсіндіріңіз.
27. Вандер-Вальс байланысын
түсіндіріңіз.
28. Иондық байланыс және оның
энергиясын көрсетіңіз, Моделунг
тұрақтысының қызметін
ашыңыз.
29. Металдық байланысты
түсіндіретін теорияларға талдау жасаңыз.
30. Диэлектрик материалдардың активті және пассивті
қасиеттерін ашыңыз.
1
Қандай зат болмасын үш агрегатты күйдің біреуінде: қатты, сұйық немесе газ тәрізді болады. Бұлардың бір-бірінен өзгешеліктері неде? Газдың бөлшектері (атомдары, молекулалары) ешқандай ережеге бағынбай ретсіз бос қозғалыста болады. Сұйықты құрайтын бөлшектерде тек қана жақындық реттік сақталады, ал қатты денелердің атомдары белгіленген реттікпен орналасады. Атомдардың, молекулалардың белгіленген заңдылықпен кеңістікте дұрыс орналасулары кристалдық күйін сипаттайды. Сол себепті физикада кристалдық күй немесе қатты күй деген ұғымдар бірдей қолданылады. Нақты кристалдың атомдарының (иондарының) өзара орналасуы оның атомдық -кристалдық құрылымы деп аталады. Металл кристалын еркiн орналасқан электрондардан тұратын “газдың” қоршауындағы оң зарядты иондар жиынтығы деп қарастыруға болады. Электрондар мен иондар жиынтығының арасындағы байланыс электрстатикалық күш арқылы ұсталады. Мұндай байланыс металдық байланысқа жатады. Демек, металдық байланыс – оң зарядты иондар мен еркін қозғала алатын валенттік электрондар газының арасындағы байланыс. Металдық байланыс күші иондар мен электрондар аралығындағы тебу және тартылу күшiмен анықталады. Атомдар бiр-бiрiмен әрекеттесу энергиясы аз жұмсалатындай қашықтықта орналасады Атомдар бiр-бiрiне қашықтығынан жақын немесе қашықтығынан алыс орналасу үшін тебу немесе тартылу күшіне қарсылық көрсететін күш жұмсалуы керек. Қатты күйде атомдар әр заттың өзіне тән ретімен орналасып, кеңістікте кристалдық тор құрады. Иондар осы тордың түйіндерінде тербелмелі жылулық қозғалыста болады. Ал электрондар – олардың арасындағы кеңістікте химиялық байланысты қамтамасыз етеді.Сонымен, кристалдық тор деп – шартты түрде, түйіндерінде материалдық бөлшектер (иондар) орналасқан, түйіндердің арасы ойша сызықпен жалғасқан кеңістіктегі торды айтады.Кристалдық тор құрылысын толық бейнелеу үшін оның бір дара бөлігін алып бір жазықтықта жатпайтын X, Y, Z координаталарының бойына орналастыралық. Мұндағы координатаның өстеріне параллель және бір-бірінен a, b, c қашықтықта жүргізілген жазықтықтар кристалды өзара тең және параллель бағдарланған көптеген параллелепипедтерге бөледі. Кристалдық тордың симметриясын, атомдардың орналасу ретін, тығыздығын, т.б. қасиеттерін сақтайтын ең кіші бөлігі (дара параллелепипед) элементар тор немесе торұя деп аталады. Кристалдық тор құратын элементар торлардың барлығының сырт пішіні мен көлемі бірдей. Атомдар элементар торлардың тор түйіндеріне немесе тор орталықтарына, қабырғаларына орналасулары мүмкін. Егер атомдар тек тор түйініне орналасса ондай элементар тор қарапайым, егер басқалай орналасса күрделі деп аталынады. Элементар торлардың сырт пішініне және ондағы атомдардың орналасу ретіне сүйеніп кристалдың геометриялық сипаттамасын, демек оның атомдық-кристалдық құрылымын зерттеуге болады. Кристалдық торды сипаттайтын параметрлерге a, b, c қабырғалары және X, Y, Z өстерінің арасындағы a, b, g бұрыштары жатады. Көптеген металдың атомдары көлемі орталықтанған текше тор, жағы орталықтанған текше тор, гексагональді тығыз орналасқан тор, т.б. торлар құрайды. Кристалдық тордың өлшемі параметрлерімен анықталады. Параметрлер қатарына тор периоды, координациялық сан және т.б. жатады.Элементарлы торға іргелес жатқан екі атомның арақашықтығы тор периоды деп аталады. Өлшемі нанометр, 1нм=10-9 см. Тор периоды a, b, c әріптерімен белгіленеді.Металдық байланысы бар заттарда атомдар симметриясы жоғары, тығыздығы жоғары, ықшамды кристалдық торлар құрады. Жалпы кристалдық торлардағы кез келген жеке атомның төңірегінде бірдей қашықтықта орналасқан көрші атомдарының саны – кристалдық тордың координациялық саны (К) деп аталады. Ол атомдардың кеңістікте, координациялық сфераның ішінде орналасу ретін көрсетеді.Қатты заттарда атомдардың 14 элементар торы кездеседі. Олардың ішінде металдар көбінесе көлемдік центрленген куб (КЦК), беттік центрленген куб (БЦК), гексагональді тығыз торға (ГТТ) кристалданады. Кристалдық торы КЦК металдарға (К= 8) - K , Na, W, V, α-Fe, Cr, Nb, БЦК металдарға (К= 12) - Cu, Pb, Pt, Al, Ag, Au, β-Fe, ГТТ металдарға (К= 12) - Mg, Be, Cd, Zn, Os, α-Ti жатады.а) көлемдік центрленген кубтық тор ; б) беттік центрленген кубтық тор; в) гексагональді тығыз тор.
2
Ұқсастықтары
және айырмашылықтары. Физикада қатты дене деп тек кристалл
денелерді айтады. Аморфты денелердің сырт қарағанда
көлемін және пішінін сақтауы оларды қатты дене етіп
көрсеткенімен, бұл денелер өте тұтқыр
сұйық деп қарастырылады. Температура жоғарылаған
сайын олардың сұйыққа тән қасиеттері бірден
көріне бастайды, бірте-бірте еріп, сүйықтың
барлық қасиеттеріне ие болады.
Аморфты денелер – изотропты. Кристалдың
қасиеттері әр түрлі бағыттарда түрліше болады.
Кристалдар – анизотропты.
Аморфты денелер. Атомдарының ретті
орналасуы алыс қашықтықтарда да қайталанып отыруымен
сипатталатын кристалдық денелерден аморфты денелердің
айырмашылығы, мұнда тек жуық тәртіп қана орын
алады. Кейбір
заттар кристалл және аморфтық түрде де бола алады.
Кристалдар. Өзінің формасын да,
көлемін де сақтайтын затты қатты дене деп атайтынымыз
белгілі. Бірақ бұлар заттың қатты күйін тек
сыртқы түріне қарап қана сипаттайды. Физикалық
тұрғыдан алғанда біз бұл белгілеріне қарап
қатты күйді сұйық күйден айыра аламыз.
Кристалдардың ішкі
құрылымсын рентген сәулелерінің көмегімен
зерттеулер олардағы бөлшектердің (молекулалар, атомдар
және иондардың) дұрыс орналасатынын көрсетті,
яғни олар кристалдық (кеңістіктік) тор түзейді.
Кристалдық тордағы қатты дененің
бөлшектерінің ең орнықты тепе-теңдік
қалпына сәйкес нүктелері тордың түйіндері деп
аталады.
Кеңістіктік тор. Криталдағы
бөлшектердің дұрыс орналасуын кристалдардың кейбір
қасиеттерінің бағытқа тәуелділігі, яғни
анизотропиясы шығады.
Анизотропия қасиетінің тек
монокристалдарға ғана тән болатындығын да айта кетейік.
Қатты денелердің көпшілігінің құрылымы
поликристалды (грек. поли - көп), яғни микроскоппен ғана
көруге болатын өте ұсақ кристалдардың
жиынтығынан тұрады. Поликристалды денелер мен аморфты
денелердің айырмашылығы мынада: поликристалдық
денелердің анизотропия байқалатын өте кішкентай бөлігін
бөліп алуға болады, ал аморфты денелердің кез-келген
бөлігін қарастырсақ та, ол әрқашан изотропты.
Кристалдық
құрылымдардың түрлері. Кристалдардың әр
түрлі типтерін және кристалдық торда орналасу
мүмкіндіктерін кристаллография зерттейді. Кристал торының
түйіндерінде орналасқан бөлшектер арасында әрекет
ететін күштердің сипаты бойынша кристалдық
құрылымдарды төрт түрге бөледі: иондық,
атомдық, молекулалық және металдық.
Тор түйіндерінде бейтарап
атомдардың болуымен сипатталатын құрылым, атомдық
кристалдық құрылым деп аталады. Олар коваленттік
байланысқан. Коваленттік байланыс деп іргелес орналасқан екі
атомның өзара екі валенттік электрондар алмасуы кезінде туатын
тартылыс күшінің салдарынан пайда болатын байланысты атайды.
Деформацияның түрлері.
Қайсыбір себептердің әрекетінен дене пішінінің
(формасының) немесе көлемінің өзгеруін деформация деп
атайды.
1. Түсірілген күштің
әрекетінен дене ұзындығының бір бағытта созылуын
бойлық созылу деформациясы деп атайды.
2. өзін бір бағытта сығып
жатқан күштің әрекетінен дене
ұзындығының кемуі бойлық сығылу деформациясы деп
атайды.
3. Денені барлық бағытта созып
жатқан күштің әрекетінен дене көлемінің
ұлғаюы барлық жаққа созылу деформациясы деп
аталады.
4. Жан-жақтан сығатын
күштің әрекетінен дене көлемінің кемуі
барлық жақтан сығылу деформациясы деп аталады.
5. осіне перпендикуляр күштің
әрекетінен шыбықтың майысуы көлденең майысу
деформациясы деп аталады.
6. Дененің параллель
қаьбаттарының бір-біріне қатысты қос күштің
әрекетінен бұрылуы бұралу деформациясы деп аталады.
7. Дененің параллель
қабаттарының бір-біріне қатысты салыстырмалы түрде
параллель орын ауыстыруы ығысу деформациясы деп аталады.
Жоғарыда айтылып кеткен
деформациялардың әрқайсысы кіші де, үлкен де бола
алады. Олардың әрбіреуін rа абсолют деформациямен бағалауға болады.
Абсолют деформация дп күш әрекетінен болған дененің
қайсыбір өлшемінің сандық өзгерісін атайды.
Деформацияланған қатты денедегі
ішкі күштердің әрекетін сипаттайтын шама механикалық
кернеу деп аталады.
SI жүйесінде бірлігі ретінде
қимасының 1м2 ауданына 1 Н ішкі күш әрекет ететін
материалдың механикалық кернеуі алынады.
Серпімділік, иілгіштік, морттық
және қаттылық. Қатты дененің кез келген
деформациясы кезінде ішкі күштердің әрекетінен денені
құрайтын бөлшектер бір-біріне қатысты ығысады. Бұл
материалда деформацияға қарсы әрекет ететін күштерді
тудырады. Серпімділік күштері деп аталатын осы күштер
деформацияланған дененің ішінде, оның жеке
бөліктерінің арасында, дененің джеформациясын тудыратын
басқа денелерге де әрекет етеді. Олар деформацияланған
дененің бұрынғы пішінін және көлемін
қалпына келтіруге тырысады. Деформацияланған дененің
сыртқы күштердің әрекеті тоқтағаннан кейін
өзінің бұрынғы пішіні мен көлемін қабылдау
қасиеті серпімділік деп аталады. Денеге түсірілдген сырқы күштердің
әрекеті тоқтаған бойда жоғалатын дененің
деформациясы серпімді деформация деп аталады.
Денеге түсірілген сырқы
күштердің әрекеті тоқталған кейін де деформацияны
сақтап қалу қасиеті иілгіштік (пластьикалық) деп
аталады. Іс жүзінде аз жүктемелер кезінде серпімді деформацияланатын,
ал сырқы жүктемені арттырған кезде қалдық
деформация пайда болмастан бұрын қирайтын материалдар кездеседі.
Мұндай метериалдар морт материалдар деп аталады (шыны, кірпіш,
керамика).Материалдың қаттылығын түрліше
күштермен анықтайды. Көбіне қаттырақ материалдар
деп екінші материалдың бетіне сызған кезде із қалдыратын
материалды айтады. Ең қатты материал – алмаз.Гук заңы.
Серпімділік модулі. Серпімді деформация мен материалдардағы ішкі
күштердің арасындағы байланысты тұңғыш
тағайындаған ағылшын ғалымы Р.Гук. Гук
заңының тұжырымдамасы мынандай: серпімді
деформацияланған денедегі механикалық кернеу осы дененің
салыстырмалы деформациясына тура пропорционал.Материалдағы
механикалық кернеудің зат тегіне және сыртқы
шарттарға тәуелділігін сипаттайтын k шамасы серпімділік молулі деп
аталады. Серпімділік молулі материалдағы салыстырмалы серпімді деформация
бірге тең кезде пайда болатын механикалық кернеумен
өлшенеді.
Балқу және кристалдану.
Балқу температурасы. Заттың қатты күйден
сұйық күйге өтуі балқу, ал сүйық
күйден қатты күйге өтуі қатаю немесе кристалдану
деп аталады.
Заттың балқу немесе қатаю
поцесстері кезінде оның ішкі энергиясының заттың тегіне
және сыртқы шарттарға тәуелділігін сипаттайтын шамасы
меншікті балқу жылуы деп аталады. Ол осы заттың балқу температурасында
алынған бірлік массасын балқытуға қажетті жылу
мөлшерімен өлшенеді.
Заттың қалыпты атмосфералық
қысым кезінде балқу температурас заттың балқу
нүктесі деп аталады. Қатты денелердің кебуі
сүйықтардың білануына ұқсас. Қатты денелердің
кебуі сублимация немесе құрғау деп аталады. Көбіне
газ күйінен сүйық күйге тоқтамай, бірден
қатты күйге өтетін кері процесті де бақылауға
болады (десублисация). Бұған терезе әйнегіндегі қырау
мысал бола алады, бұл ауадағы су буының бірден
мұзға айналуы.
Берілген зат үшін осы заттың
үш фазасы да тепе-теңдікте болатын С нүктесінде р және
Т шамаларының бір ғана мәні сәйкес келеді. Зат
күйлерінің диаграммасындағ С нүктесін заттың
барлық үш фазасының арасындағы тепе-теңдікті
өрнектейтін үштік нүкте деп атайды. Судың үштік
нүктесінде қысым 610 Па, ал температура 273,16 К.
3.
Симметрия элементтері жәнесимметрия операциялары Кристалдар симметриясы – кристалл бөліктерінің симметрия жазықтығы, осі не нүктесі бойынша кеңістікте белгілі бір заңдылықпен қайталанып келуі. Симметрия жазықтығы деп кристалды айнадай тең екіге бөлетін жазықтықты айтады. Оны Р әрпімен белгілейді. Кристалдарда оның саны бір, екі, үш, төрт, бес, алты, жеті және тоғыз болуы мүмкін. Симметрия жазықтығының санын Р әрпінің алдына жазады. Кейбір кристалдарда симметрия жазықтығы болмайды. Кубта симметрия жазықтығы тоғыз болады. Симметрия орталығы деп кристалл ішінде өзінен екі жаққа бірдей қашықтықта қарама-қарсы орналасқан кристалл бөліктерін біріктіретін түзу сызық өтетін нүктені айтады. Оны С әрпімен белгілейді. Симметрия осі деп кристалды айналдырғанда оның бірдей бөліктерінің қайталанып келетін сызығын айтады. ‘’Оны: L2, L3, L4 және L6 деп белгілейді.’’ Симметрия остері бірнешеу болуы мүмкін. Олардың саны әріптің алдында жазылады. Егер кристалды белгілі бұрышқа айналдырғанда, оның бейнесі орт. нүкте бойынша өз-өзіне айнадағыдай сәйкес келсе, онда бұл сызықты инверсиялық ось деп атайды. ‘’Оларды Lі, Lі2, Lі3, Lі4, Lі6 деп белгілейді. ‘’Әрбір кристалдық формада симметрия элементтерінің бірнеше түрлері болады. Оларды жазғанда: алдымен жоғарыдан төмен дәрежелі осьтер, одан кейін жазықтықтар, соңында симметрия орталығы көрсетіледі. Кристалдардың симметрия элементтері белгілі бір үйлесімде келеді. Осындай үйлесімдерді симметрия түрлері дейді. Олардың саны 32. Симметрияның осы 32 түрі элементтердің үйлестігіне, кристаллогр. тұрақтыларының сәйкестігіне және бұрыштарының бірдейлігіне қарай 7 жүйеге немесе сингонияға топтастырылады: триклиндік, моноклиндік, ромбылық, тригоналдық, тетрагондық, гексагондық және кубтық.
4.
Кристалдық тор – кристалл заттардағы атомдардың, иондардың, молекулалардың белгілі бір ретпен орналасуы. Кристалдық тор бір-біріне тығыз орналасқан параллелепипедтерден немесе кубтардан тұрады. Параллелепипед пен кубтар кристалдық тордың ұяшығы болып табылады. Атомдар, иондар немесе молекулалар орналасқан параллелепипедтің төбелері (бұрыштары) кристалдық тордың түйіндері, ал олар арқылы өтетін түзу сызықтары қатарлары деп аталады. Бір қатарда жатпайтын үш түйін арқылы өтетін жазықтықты жазық торапдейді. Элементар ұяшықтың үш бағыттағы сызықтық өлшемдері мен оның жақтарының аралық бұрыштары кристалдық тордың параметрлері болып табылады. Кристалдық тордың өлшемдері, атомдары мен молекулалардың орналасуы рентгенография, электронография, нейтронография көмегімен анықталады. Кристалдық тор статистикалық тұрғыдан тұрақсыз болады, атомдар мен иондар өзінің тепе-теңдік қалпынан белгілі бір амплитудада тербеліп тұрады. Температура өскен сайын бұл тербеліс артады, ал балқу температурасына жеткенде, кристалдық тор ыдырап, зат сұйықтыққа айналады.[1].[2]
Брав торлары




Түрлері
Кез келген затты қатты күйіне айналдыруға болады. Ал қатты заттар кристалдық торларының болуымен сипатталады. Кристалдық торлар деп - түйіндеріндегі бөлшектер белгілі бір ара қашықтықтан кейін жүйелі қайталанатын ретті құрылымды айтамыз. Егер заттың құрамында құрылыс бірліктері ретсіз орналасса, зат аморфты болады. Кристалдық торлар түйіндеріндегі бөлшектердің табиғатына қарай жіктеледі. Олардың төрт түрі белгілі.
|
Тордың типі |
Қүрылыс бірлігі |
Бөлшектердің арасындағы байланыс типі |
Балқу температурасы |
Ерігіштігі |
Мысалдар |
|
Атомдық |
Бейтарап атомдар |
Ковалентті |
Жоғары |
Ерімейтін |
С, Si, SiO2 |
|
Молекулалық |
Молекулалар |
Әлсіз молекулааралық байланыстар |
Төмен |
Органикалық еріткіштер мен суда ериді |
Барлық газдар, жай заттар, І2, Вr2, қышқылдық оксидтер, қышқылдар, органикалық заттар |
|
Иондық |
Иондар |
Иондық |
Жоғары |
Суда ерімтал келеді |
Металдар мен бейметалдардан түратын заттар, гидроксидтер, тұздар |
|
Металдық |
Металл атомдары мен катиондары |
«Электрон» газы |
Әр түрлі |
Ерімейтін Металдар |
Example |
Бұл кестеден мынаны көруге болады:
1. Атомдық кристалдық торлы заттарда (а) байланыс ковалентті, оны үзу үшін арнайы химиялық реакциялар жүргізу қажет. Қалыпты жағдайда олардың барлығы қатты, балқу температуралары жоғары, ерігіштігі өте нашар заттар.
2. Молекулалық кристалдық торлы заттар (ә) түйіндерінде молекулалар орналасқан, ал молекулааралық тартылыс күші өте аз болуына байланысты мұндай кристалдық торлы заттардың көпшілігі қалыпты жағдайда газ күйінде кездеседі. Оларды қыздырғанда оңай балқиды немесе температура әсерінен ыдырап кететін беріктігі нашар қосылыстарға жатады.


3. Ионды кристалдық тop (б) түйіндерінде иондар орналасқан, олар суда жақсы ериді, ерітінділері мен балқындылары электр тоғын жақсы өткізетін қатты заттар.
4. Металдық кристалдық тop (в); Металдарда металдық байланыстар болады, себебі кристалдық торларының түйіндерінде металл атомдары мен иондар орналасқан, ал металдың көлемінде электрон бұлттары (валенттілік электрондар оңай белініп шығады, өйткені олар ядромен нашар байланысқан) еркін қозғалып жүреді. Осы электрондар металдық қасиеттерді анықтайды:
а) жоғары жылу және электрөткізгіштік
ә) металдық, жылтыр
б) созылғыштық, тапталғыштық
Заттардың физика-химиялық қасиеттері олардың кристалдық торларының типтеріне тәуелді болады.
5.
Элементар ұяшық. Қандай зат болмасын үш агрегатты күйдің біреуінде: қатты, сұйық немесе газ тәрізді болады. Бұлардың бір-бірінен өзгешеліктері неде? Газдың бөлшектері (атомдары, молекулалары) ешқандай ережеге бағынбай ретсіз бос қозғалыста болады. Сұйықты құрайтын бөлшектерде тек қана жақындық реттік сақталады, ал қатты денелердің атомдары белгіленген реттікпен орналасады. Атомдардың, молекулалардың белгіленген заңдылықпен кеңістікте дұрыс орналасулары кристалдық күйін сипаттайды. Сол себепті физикада кристалдық күй немесе қатты күй деген ұғымдар бірдей қолданылады.
Нақты кристалдың атомдарының (иондарының) өзара орналасуы оның атомдық -кристалдық құрылымы деп аталады.
Металл кристалын еркiн орналасқан электрондардан тұратын “газдың” қоршауындағы оң зарядты иондар жиынтығы деп қарастыруға болады. Электрондар мен иондар жиынтығының арасындағы байланыс электрстатикалық күш арқылы ұсталады. Мұндай байланыс металдық байланысқа жатады. Демек, металдық байланыс – оң зарядты иондар мен еркін қозғала алатын валенттік электрондар газының арасындағы байланыс.
 2.1- сурет. Екі атомның атомаралық
қашықтығына қарай әрекеттесу энергиясының
схемасы
2.1- сурет. Екі атомның атомаралық
қашықтығына қарай әрекеттесу энергиясының
схемасы
Металдық байланыс күші иондар мен электрондар аралығындағы тебу және тартылу күшiмен анықталады.
Атомдар бiр-бiрiмен әрекеттесу энергиясы аз
жұмсалатындай қашықтықта  орналасады (2.1-сурет). Атомдар бiр-бiрiне
орналасады (2.1-сурет). Атомдар бiр-бiрiне  қашықтығынан жақын немесе
қашықтығынан жақын немесе  қашықтығынан алыс орналасу
үшін тебу немесе тартылу күшіне қарсылық
көрсететін күш жұмсалуы керек.
қашықтығынан алыс орналасу
үшін тебу немесе тартылу күшіне қарсылық
көрсететін күш жұмсалуы керек.
Қатты күйде атомдар әр заттың өзіне тән ретімен орналасып, кеңістікте кристалдық тор құрады. Иондар осы тордың түйіндерінде тербелмелі жылулық қозғалыста болады. Ал электрондар – олардың арасындағы кеңістікте химиялық байланысты қамтамасыз етеді.
Сонымен, кристалдық тор деп – шартты түрде, түйіндерінде материалдық бөлшектер (иондар) орналасқан, түйіндердің арасы ойша сызықпен жалғасқан кеңістіктегі торды айтады.
Кристалдық тор құрылысын толық бейнелеу үшін оның бір дара бөлігін алып бір жазықтықта жатпайтын X, Y, Z координаталарының бойына орналастыралық (2.2- сурет). Мұндағы координатаның өстеріне параллель және бір-бірінен a, b, c қашықтықта жүргізілген жазықтықтар кристалды өзара тең және параллель бағдарланған көптеген параллелепипедтерге бөледі. Кристалдық тордың симметриясын, атомдардың орналасу ретін, тығыздығын, т.б. қасиеттерін сақтайтын ең кіші бөлігі (дара параллелепипед) элементар ұяшық немесе торұя деп аталады.
Кристалдық тор құратын элементар торлардың барлығының сырт пішіні мен көлемі бірдей. Атомдар элементар торлардың тор түйіндеріне немесе тор орталықтарына, қабырғаларына орналасулары мүмкін. Егер атомдар тек тор түйініне орналасса ондай элементар тор қарапайым, егер басқалай орналасса күрделі деп аталынады.
 Дара
кристалдық тор (элементар тордың a, b, c, a, b, g
параметрлері көрсетілген)
Дара
кристалдық тор (элементар тордың a, b, c, a, b, g
параметрлері көрсетілген)
Элементар торлардың сырт пішініне және ондағы атомдардың орналасу ретіне сүйеніп кристалдың геометриялық сипаттамасын, демек оның атомдық-кристалдық құрылымын зерттеуге болады.Кристалдық торды сипаттайтын параметрлерге a, b, c қабырғалары және X, Y, Z өстерінің арасындағы a, b, g бұрыштары жатады. Көптеген металдың атомдары көлемі орталықтанған текше тор, жағы орталықтанған текше тор, гексагональді тығыз орналасқан тор, т.б. торлар құрайды. Кристалдық тордың өлшемі параметрлерімен анықталады. Параметрлер қатарына тор периоды, координациялық сан және т.б. жатады.Элементарлы торға іргелес жатқан екі атомның арақашықтығы тор периоды деп аталады. Өлшемі нанометр, 1нм=10-9 см. Тор периоды a, b, c әріптерімен белгіленеді.Металдық байланысы бар заттарда атомдар симметриясы жоғары, тығыздығы жоғары, ықшамды кристалдық торлар құрады. Жалпы кристалдық торлардағы кез келген жеке атомның төңірегінде бірдей қашықтықта орналасқан көрші атомдарының саны – кристалдық тордың координациялық саны (К) деп аталады. Ол атомдардың кеңістікте, координациялық сфераның ішінде орналасу ретін көрсетеді.Қатты заттарда атомдардың 14 элементар торы кездеседі. Олардың ішінде металдар көбінесе көлемдік центрленген куб (КЦК), беттік центрленген куб (БЦК), гексагональді тығыз торға (ГТТ) кристалданады (2.3-сурет). Кристалдық торы КЦК металдарға (К= 8) - K , Na, W, V, α-Fe, Cr, Nb, БЦК металдарға (К= 12) - Cu, Pb, Pt, Al, Ag, Au, β-Fe, ГТТ металдарға (К= 12) - Mg, Be, Cd, Zn, Os, α-Ti жатады.

а) көлемдік центрленген кубтық тор ; б) беттік центрленген кубтық тор; в) гексагональді тығыз тор.
2.3 – сурет. Кристалдық тор типтері
6,7.


Кубалық кристалдардағы түрлі Миллер индекстерімен ұшақтар
Миллердің көрсеткіштері кристаллдағы атомдық ұшақтардың орналасуын сипаттайтын кристаллографиялық көрсеткіштер . Миллердің көрсеткіштері таңдалған жазықтықтың кристаллографиялық координат жүйесінің үш осында қиылған сегменттерімен байланысты (міндетті түрде Картесандық емес). Осылайша ось мен жазықтықтың салыстырмалы орналасуының үш нұсқасы мүмкін:
- ұшақ барлық үш осьтің қиылысында
- Ұшақ екі осі қиылысады, ал екіншісі параллель
- жазықтық бір осьті қиып, екіншісіне параллельді
Миллер индексі жақшаларда жазылған үш салыстырмалы негізгі бүтін санға ұқсас: (111), (101), (110) ...
Гексагональді тығыз пакет үшін Miller-Bravais индексі
Үшбұрышты тормен жұмыс істеу үшін үшінші элемент i- ыңғайлы, бірақ кем-нұқсан келтіретін (ешқандай қосымша ақпарат бермейтін) компонент -h- k дегенді білдіретін төрт таңбалы Miller-Bravais индекстерін ( hkil ) пайдалану ыңғайлы. H , i және k көрсеткішінің компоненттері арасындағы бұрыш 120 градусты құрайды, сондықтан олар ортогоналды емес. L компоненті h , i және k барлық үш бағытына перпендикуляр.
8,9.
Кері кеңістік пен оң кеңістіктің байланысы.
Кері (полюстік) тор — бастапқы кеңістік тордың (100), (010), (001) координаталық торлары оларға нормаль координаталық осьтермен алмастырылған қосымша құрылыс. Кері тор кристаллографияның есептеу әдістерінде көп қолданылады.
Кристаллография – кристалдар мен кристалл заттар туралы ғылым. Ол кристалл заттардың құрамы мен құрылысын, пішінін, қасиеттерін, олардың өзара және сыртқы ортамен байланысын және кристалдық күйін зерттейді. Геометриялық Кристаллография кристалл заттардың симметриясын, пішінін, кеңістік құрылысының геометриялық заңдылықтарын зерттейді. Физикалық Кристаллография кристалдардың қасиеттерін зерттейді. Химиялық Кристаллография кристалл заттарды құрамымен байланысты қарастырады. Қазіргі кезде химия және физика ғылымдары аралығындағы кристаллографияның салалары жеке ілім – кристаллохимия, кристаллофизика ретінде қарқынды дамуда.
10.
Материалдың механикалық қасиетіне,соның ішінде беріктікке анықтама беріңіз. Сырттан түскен механикалық күштерге материалдардың қарсылық көрсетер қабілеті оның механикалық қасиетіне жатады. Механикалық қасиет материалдың химиялық құрамына, құрылымына, технологиялық өңдеу тәсілдеріне және басқа факторларға байланысты қалыптасады. Механикалық қасиеттер материалдың деформацияға қарсылығы (беріктік, қаттылық) және қирауға қарсылығы (созылмалығы, соққы тұтқырлығы) арқылы сипатталады.Материалға түскен жүктемелердің әсерінен олардың ішкі құрылысында созылу, майысу, сығылу, бұралу, опырылу деформациялары пайда болады. Түскен жүктемелердің әсерінен материал қирауы мүмкін, осындай қирауларды және қалдық деформацияларды болдырмау үшін материалдың механикалық қасиетін білу керек. Материалға түсетін күштер статикалық, динамикалық және циклді (айнымалы) болып ажыратылады. Сонымен қатар материалдар әртүрлі температурада, агрессиялы орталарда деформацияларға және қирауға ұшырайды.Үлгіге түсетін күштің біртіндеп баяу берілуі статикалық сынаққа жатады. Статикалық сынақтармен материалдың беріктігі, қаттылығы, созымталдығы анықталады. Динамикалық күш материалға кенеттен және соққы ретінде түседі. Динамикалық сынақпен материалдың соққы тұтқырлығы анықталады. Циклдік немесе айнымалы сынақ кезінде материалға берілетін күштің мөлшері немесе бағыты өзгеріліп отырады, кейбір кезде бағыты мен мөлшері қоса өзгеруі мүмкін. Циклді сынақ арқылы материалдың төзімділігі, шалдығуы анықталады.Материалдың негізгі механикалық қасиеттеріне беріктігі, қаттылығы, серіппелігі, созымталдығы, соққы тұтқырлығы жатады. Беріктік деп сырттан түскен күштің әсерінен материалдың қирауына немесе қалдық деформацияның туындауына қарсылық көрсетер қабілеті аталады. Мұнда материалдың меншікті беріктігінің маңызы зор. Меншікті беріктікті беріктік шегінің материалдың тығыздығына қатынасы арқылы табады, σв / γ. Мұнда, σв – беріктік шегі; γ – меншікті салмағы. Қаттылық деп материалдың өзінен қаттылығы жоғары дененің әсерінен туындаған беттік деформацияға қарсылық көрсетер қабілеті аталады. Серпімділік деп деформацияланған материалдың түскен күшті тоқтатқанда бастапқы қалпына оралу қабілеті аталады. Созымталдық деп түскен күштің әсерінен материалдың басқы пішіні мен өлшемдерінің өзгеру қабілеті аталады. Соққы тұтқырлығы деп соққы күштерінің әсерінен материалдың қирауына қарсылық көрсетер қабілеті аталады. Аталған түрлерінен басқа механикалық қасиетке төзімділік, шалдығу, жылжыпсырғымалылық және басқаларды жатқызуға болады. Механикалық қасиеттерінің сипаттамалары арнаулы сынақтар арқылы анықталады.
11.
Материалдың механикалық қасиетіне,соның ішінде қаттылыққа анықтама беріңіз. Қатты денелердің барлық қасиеттерінің ішіндегі ең маңыздысы олардың механикалық қасиеттері - беріктілігі, қаттылығы, пластикалығы, тез тозбайтындығы және т.б. болып табылды. Осы қасиеттеріне байланысты қатты денелер конструкциялық, құрылыстық, электротехникалық, магниттік және басқа салаларда ең бағалы материалдар ретінде кеңінен қолданылады. Қаттылық (орыс. твердость — металдың ішіне басқа қаттырақ дененің кіруіне қарсылық жасау қабілеті; материалдардың жергілікті жанасқан күштік әсерлер кезінде беттік қабатының созымды деформацияға немесе морт қирауға қарсыласу қасиеті тексеру.
12.
Материалдың механикалық қасиетіне,Юнг модуліне анықтама беріңіз. Юнг модулі немесе серпімділік модулі - Материалдағы механикалық кернеудің зат тегіне және сыртқы шарттарға тәуелділігін сипаттайтын шама. Басқаша айтқанда заттың серпімді деформация кезіндегі созылу не сығылуға қарсылық білдіру қасиетін сипаттайтын шама. XIX ғасыр ағылшын физигі Томас Юнг құрметімен аталған. Механиканың динамикалық есептерінде Юнг модулі жалпы мағынасында пайдаланылады — орта мен процесс функционалы ретінде. Халықаралық бірліктер жүйесінде (СИ) ньютон метр квадратқа немесе паскальмен өлшенеді.
Юнг модулі келесідегідей есептеледі:
{displaystyle E={frac {F/S}{x/l}}={frac {Fl}{Sx}},}
мұндағы:
E — серпімділік модулі,
F — күш,
S — күш әсер ететін бет ауданы,
l — деформацияланатын білік ұзындығы,
x — серпімді деформация кезіндегі білік ұзындығы өзгерісі модулі (өлшем бірлігі ұзындық l сияқты).
Юнг модулі арқылы бойлық толқын таралу жылдамдығы жіңішке білікте былай есептеледі:
{displaystyle c={sqrt {frac {E}{ ho }}},}
мұндағы {displaystyle ho } — зат тығыздығы.
Кейбір материалдар үшін Юнг модулі мәні
|
Никель |
210 |
|
Қалайы |
35 |
|
Қорғасын |
18 |
|
Күміс |
80 |
|
Сұр шойын |
110 |
|
Болат |
210 |
|
Әйнек |
70 |
|
Титан |
120 |
|
Фарфор |
59 |
|
Цинк |
120 |
|
Хром |
300 |
14.
Деформация ұғымына анықтама беріңіз. Түскен күштiң әсерінен дененің сырт пішінінің, өлшемдерінің өзгеруі деформация деп аталады. Шағын кернеудің әсерінен туындап, ол кернеуді алып тастағанда бірге жойылатын деформация серпiмдi, ал сақталып қалатын деформация пластикалық деп аталады. Кернеуді әрі қарай көтергенде туындаған деформация қираумен аяқталуы мүмкін. Серпiмдi және пластикалық деформацияның жүру сарыны физикалық тұрғыдан бір – біріне ұқсамайды. Серпімді деформация туындаған металдың микроқұрылымы өзгемейді, кристалл торындағы атомдар тепе-теңдік күйден ауытқып арақашықтықтары өзгереді. Деформация тудырған күшті тоқтатқан кезде орын ауыстырған атомдар бастапқы тепе-теңдік күйіне оралады.





а) б) в) г) д)
а) бастапқы құрылым; б) серпімді деформация; в) серпімді және пластикалық деформация; г)- сырғып деформацияланған құрылым; д)- қосарланып деформацияланған құрылым. 4.1- сурет. Деформация түрлері
Пластикалық деформация туындаған металдың құрылымы керi айналмайтындай өзгередi, қасиетi бiрге өзгередi. Пластикалық деформация туындағанда кристалдың бір бөлiгi екінші бөлiгiне қарағанда бiр тор периодына жылжып ауысады. Бірақ мұндай жылжу бір атомдық жазықтықтың тұтас бірден сырғуы деп түсінуге болмайды, біртіндеп жылжу жазықтығының бойымен дислокациялардың орын ауыстыруы деп қарау керек, ал кристалдың бетінде саты пайда болады. Дислокация кристалдың бір жағынан басталып екінші жағына жылжуының нәтижесінде дара кристалдың бір бөлігі бір атомдық арақашықтыққа ауысып отырады. Пластикалық деформация осылай жүріп отырады. Сондықтан пластикалық деформация процесінде дислокация ең маңызды және шешуші роль атқарады. Пластикалық деформация тудыратын күштердің мөлшері деформациялау температурасы мен оның жылдамдығына байланысты. Пластикалық деформацияға қажетті күш температура көтерілген сайын азаяды. Деформациялау жылдамдығы артқан сайын пластикалық деформациялау процесі қиындай түседі.Металдың пластикалық деформацияға бейімділігі оның өте маңызды және пайдалы қасиеттерінің біріне жатады. Мұндай қасиеті жоқ металды қысыммен өңдеу – илемдеу, сымдау, соққылау, штамптау және басқадай басып өңдеу мүмкін болмас еді. Пластикалық деформацияға ұшырамаған бұйымның қирауына аз мөлшердегі күш те жеткілікті болады.Металдар көбінесе түскен күштің әсерінен ығысуға емес созылуға немесе сығылуға қарсылық көрсетуге бейімді. Сондықтан пластикалық деформация процесін кристалдардың бір бөлігі атомдардың ең тығыз орналасқан кристаллографиялық жазықтықтардың бойымен екінші бөлігінен әрі қарай сырғыйды немесе ығысады деп қарау керек. Сырғу кезінде кристалдық торлар бастапқы қалпын өзгертпей сақтайды. Пластикалық деформация сырғудан басқаша қосарланып жүруі де мүмкін.Қосарлану деформациясы сырғу деформациясы сияқты жылжу арқылы жүреді, тек қана кристалдың сырғып ығысқан бөлігі, ығыспаған бөлігінің айнадағы кері бейнесіндей қайырылып отырады (4.1 сурет, д). Қосарлану деформациясын тудыратын жылжу кернеуі жоғары болу керек, ол көбінесе сырғып деформациялануға мүмкіндік болмаған жайларда байқалады. КЦК, БЦК торларында қосарлану деформациясы тек төмен температурада және түскен күштің жылдамдығы өте жоғары болса ғана байқалады. Қосарланып деформациялану көбінесе гексагональді тығыз торларда (Ti, Mg, Zn) кездеседі. Гексагональды тығыз тордан тұратын металдардың созымталдығы төмен болғандықтан илемдеуге, штамптауға жарамайды.
15.
Созылу диаграммасын сызыңыз және түсіндіріңіз.

суретте үздіксіз сызықпен аз көміртекті болаттың шартты созылу диаграммасы көрсетілген. ОА аралығында кейбір пропорционалдық шегі деп аталатын σпц шамасына дейін ε деформациясы σ кернеуіне пропорционал өседі, яғни Гук заңы орындалады (Ст3 болат үшін σпц≈ 200 МПа). Содан кейін диаграмма қисық сызықтыға айналады, сонда серпімділік шегі деп аталатын, σсер шамасына дейін материал өзінің серпімділік қасиетін сақтайды. σпц және σсер арасындағы айырмашылығы аз болғандықтан (Ст3 үшін σсер≈ 210 МПа), оларды қолдану кезінде айырмайды.
Жүктемені әрі қарай өсіріп тұрғанда, бір мезгілде (С нүктесі) деформациялар, жүктеме өспесе де өсе береді. Горизонталь СDаралығы аққыштық ауданы деп, ал сәйкес кернеу – σақ аққыштық (немесе жұмсару) шегі деп аталады (Ст3 үшін 240…400 МПа).
Содан кейін диаграмма жоғары кетеді, материал созуға қарсыласу қабілетіне қайта ие болады. Е нүктесінде ең жоғары шартты кернеуге жетеміз, ол σб беріктік шегі деп немесе уақытша қарсыласуы деп аталады(Ст3 үшін σб=400…500 МПа)
Материал беріктігінің қарастырылған сипаттамаларымен қатар сынау арқылы үлгі үзілгендегі δ салыстырмалы қалдық ұзаруын анықтайды, ол материалдың пластикалық қасиетінің сипаттамасы болып келеді
 (8.21)
(8.21)
мұндағы l0 – үлгінің бастапқы есептеу ұзындығы;
l1– үлгі үзілгеннен кейін, оның есептеу ұзындығы.
Ст3 үшінδ ≥24%, жоғары берікті болаттар үшін δ=(7…10)%. Бұл ұзаруы орташа алынады, шынайы ұзаруы үзілген жерде орын алады.
Қарастырылған созылу диаграммасы пластикалық материалдарды, яғни қирамай тұрғанда айтарлықтай қалдық деформацияларға ие бола алатын мате-риалдарды сипаттайды. Пластикалық қасиеті жоғары материалдарға мыс, алюминий, латунь, аз көміртекті болат және т.б. жатады, пластикалық қасиеті аз материалдарға – легирленген болаттардың көпшілігі. Кейбір пластикалық материалдардың созылу диаграммаларында аққыштық ауданы болмайды; олар үшін шартты аққыштық шегі қолданылады - ол қалдық деформация-сының кейбір шамасына сәйкес келетін кернеу. σ0,2 шартты аққыштық шегі 0,2% тең қалдық деформациясына сәйкес болады.
Пластикалық қасиетіне керісінше морт қасиеті бар. Морт материалдар үшін δ шамасы 2-5%-дан аспайды. Морт материалдарға шойын, инструменттік болат, тас, бетон, шыны және т.б. жатады. Пластикалық және морт мате-риалдарға бөлу шартты екенін айта кету керек, өйткені сынау шарттарына (жүктелу жылдамдығына, темпе-ратураға) және кернеулі күйіне тәуелді морт материал-дардың биімділігі пластикалық материалдар секілді, ал пластикалық материалдардың биімділігі морт материалдар секілді болуы мүмкін. Мысалы, шойыннан жасалған үлгі жан-жақты сығу кезінде пластикалық қасиетіне ие болады. Ал болаттан жасалған қырнауы бар үлгі, оның δ қалдық деформациясы салыстырмалы кішкене болғанда сынады.

Морт материалдардан жасалған үлгілердің созылу диаграммаларының бір қатар ерешеліктері болады (8.11 сурет). Мұнда Гук заңынан ауытқуы өте ерте басталады. Үзілу өте аз деформациялар кезінде мойыны болмай аяқ астынан келіп қалады. Сынау кезінде тек қана σб беріктік шегін анықтайды. Есептеу жүргізгенде қисық сызықты диаграммасын түзу сызықты диаграммасына ауыстырып, Гука заңынан ауытқуы ескерілмейді. σб шамасына үлгінің өлшемдері байқалатын әсерін тигізеді, ол масштаб коэффициенті арқылы бағаланады.
16.
Кристалдардың пластикалыққа өтуінің негізгі заңдылықтары. Егер кристалдағы кернеу аққыштық шегінен артып кетсе, яғни пластикалық кристалдарды созу және сығу арқылы жасалған барлық зерттеулер кезінде қалдық деформация пайда болады. Бірақ та, осындай деформациялардың пайда болу себебі -созу немесе сығу емес. Кристалды перпендикуляр күшпен жеткілікті дәрежеде созғанда атомдар жазықтықтары арасындағы ара қашықтық артады.
 2.4 - сурет
2.4 - сурет
Осы жазықтықтарды жеткілікті дәрежеде бір-бірінен алыстатқанда олардың арасындағы тартылыс күштері сыртқы жүктемемен тепе-теңдікте бола алмайды да, кристалл бүлінеді. Сығу кезінде атомдық жазықтықтар бір-біріне атомдар арасындағы тебіліс күштері сыртқы жүктемемен теңескенше ғана жақындайды. Бұл жағдайдағы деформация идеал серпімді, ол тордағы бөлшектердің қайтымсыз орын ауыстыруларын тудырмайды.
Пластикалық
деформация сырғанаушы кернеудің нәтижесінде пайда болуы
мүмкін, ол бөлшектер арасындағы байланыстарда ешқандай
өзгерістер болмайтындай етіп, кристалдың бір бөлігіндегі
бөлшектердің басқа бөліктермен салыстырғанда орын
ауыстыруын тудырады. Осындай ығысу сырғанау деп аталады. Ол
кристалдық денелердегі пластикалыққа айналу процесінің
негізін береді. 2.4 – суретте  кристалдағы
кристалдағы
 ығыстырушы
күштің әсерінен қалдық деформацияның пайда
болу және дамуы көрсетілген. Серпімділік шегіне жеткенге дейін
кристалл серпімді деформацияланады (2.4 а-сурет) және жанама кернеу
ығыстырушы
күштің әсерінен қалдық деформацияның пайда
болу және дамуы көрсетілген. Серпімділік шегіне жеткенге дейін
кристалл серпімді деформацияланады (2.4 а-сурет) және жанама кернеу  ығысудың
салыстырмалы деформациясына
ығысудың
салыстырмалы деформациясына  тура
пропорционал артады (Гук заңы):
тура
пропорционал артады (Гук заңы):  (2.10)
(2.10)
(G — ығысу модулі); сыртқы жүктемені алып тастағаннан кейін атомдар өздерінің алғашқы күйіне қайтып келеді. Кристалл ішіндегі серпімділік шегі белгілі сырғанау жазықтықтары деп аталатын 5 жазықтықтар бойында артқанда, кристалдың бір бөлігінің екінші бөлігіне бір немесе бірнеше атомдық ара қашықтықтарға ығысуы (2.4 в-сурет) болады. Сыртқы жүктемені алып тастағанда торлардың серпімді кернеулері жойылады, бірақ та кристалдың бір бөлігінің екіншісі бөлігімен салыстырғанда ығысуы қалып қалады (2.4 г-сурет). Көптеген сырғанау жазықтықтарында өтіп жатқан осындай өте аз қайтымсыз ығысулардан кристалдың қалдық деформациясы құралады.
Болаттың пластикалық деформацияға ұшырау қабілеті - ең алдымен оның құрылымдық элементтері арасындағы байланыс күштерінің сипатына байланысты.
Қатаң бағытталғандыққа ие коваленттік байланыс атомдардың бір-біріне қатысты кішкене жылжулары кезінің өзінде-ақ бірден әлсірейді. Бұл байланыс ығысу кезінде атомдар көршілес атомдарымен байланысқа түсіп үлгенгенде дейін, жылдам бұзылады. Сондықтан, валенттік типті кристалдар (алмаз, кремний, германий, сурьма, висмут, мырыш және т.б.) пластикалық деформацияға ұшырау қабілеттіліктерін көрсетпейді. Серпімді деформация біткенде, олар морт сынғыш болады.
Бағытталу
болмайтын металдық байланыста керісінше, атомдардың бір-біріне
қатысты тангенциальды ығысулары өте нашар өзгереді.
Сондықтан, тордың бір бөлігінің екінші бөлігіне
қатысты ығысу шамасы үлкен (мыңдаған атомдық
ара қашықтықтар) болуы мүмкін, бұл
кристалдардың пластикалылықтарының жоғары
дәрежеде екендігін көрсетеді. Металдық және
иондық байланыстар арасында аралық жағдайда
тұрған, ол иондық байланыс. Ол коваленттік байланыс
сияқты бағытталған емес, бірақ та металдық
байланыс сияқты иілгіш те емес. Типтік иондық кристалдар  және
т.б. валенттік кристалдар тәрізді тез шетінегіш (сынғыш) болып
табылады. Ал хлорлы күміс кристалының пластикалылығы
жеткілікті дәрежеде жоғары.Кристалдағы сырғанау белгілі
бір кристаллографиялық жазықтықтар мен бағыттар бойында
өтеді. Өте тығыз орналастырылған атомдық
жазықтықтар мен бағыттар осындай болып келеді. Осындай
атомдық жазықтықтар мен бағыттардың
беріктігінің жоғары болуы - олардағы атомдар арасындағы
ара қашықтықтың өте аздығы және
бір-бірімен байланыстың күштілігімен түсіндіріледі.
Басқаша айтқанда, осындай жазықтықтар арасындағы
ара қашықтық үлкен, осының салдарынан
олардың арасындағыы байланыс нашар (1.17 қара). Осы
жазықтықтар мен бағыттар бойындағы сырғанау
атомдар орналасуларының ең кішкене бұзылулары кезінде
өтеді, сондықтан ең жеңіл түрі болып табылады.
Осы жазықтықта жататын сырғанау жазықтықтары мен
сырғанау бағыттарының жиынтығы сырғанау
жүйесін құрады. Кубтық қырлы центрленген торда
сырғанау жазықтығы октаэдр жазықтығы (111),
сырғанау бағыты – кеңістіктік диагональ бағыты
және
т.б. валенттік кристалдар тәрізді тез шетінегіш (сынғыш) болып
табылады. Ал хлорлы күміс кристалының пластикалылығы
жеткілікті дәрежеде жоғары.Кристалдағы сырғанау белгілі
бір кристаллографиялық жазықтықтар мен бағыттар бойында
өтеді. Өте тығыз орналастырылған атомдық
жазықтықтар мен бағыттар осындай болып келеді. Осындай
атомдық жазықтықтар мен бағыттардың
беріктігінің жоғары болуы - олардағы атомдар арасындағы
ара қашықтықтың өте аздығы және
бір-бірімен байланыстың күштілігімен түсіндіріледі.
Басқаша айтқанда, осындай жазықтықтар арасындағы
ара қашықтық үлкен, осының салдарынан
олардың арасындағыы байланыс нашар (1.17 қара). Осы
жазықтықтар мен бағыттар бойындағы сырғанау
атомдар орналасуларының ең кішкене бұзылулары кезінде
өтеді, сондықтан ең жеңіл түрі болып табылады.
Осы жазықтықта жататын сырғанау жазықтықтары мен
сырғанау бағыттарының жиынтығы сырғанау
жүйесін құрады. Кубтық қырлы центрленген торда
сырғанау жазықтығы октаэдр жазықтығы (111),
сырғанау бағыты – кеңістіктік диагональ бағыты  болады.
Гексагональды кристалдарда сырғанау жазықтығы
болады.
Гексагональды кристалдарда сырғанау жазықтығы  ретінде
базис жазықтығы
ретінде
базис жазықтығы 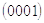 ,
сырғанау бағыты
,
сырғанау бағыты  ретінде
базис жазықтығында жатқан үш осьтің біреуі
алынады (2.5 –сурет.
ретінде
базис жазықтығында жатқан үш осьтің біреуі
алынады (2.5 –сурет.  -
деформациясын тудырушы сыртқы әсер.Көптеген зерттеулер
берілген сырғанау жүйесіндегі кристалдағы ығысу осы
жүйедегі сырғанатушы кернеу
-
деформациясын тудырушы сыртқы әсер.Көптеген зерттеулер
берілген сырғанау жүйесіндегі кристалдағы ығысу осы
жүйедегі сырғанатушы кернеу  өзінің
критикалық мәні
өзінің
критикалық мәні  жеткен
мезетте басталатынын көрсетті. 2.2 – кестеде кейбір таза металдық
монокристалдардың критикалық сырғанатушы кернеулерінің
шамалары көрсетілген. 2.2 –кесте мәліметтері бойынша ең
пластикалық монокристалдардың критикалық сырғанатушы
кернеуінің
жеткен
мезетте басталатынын көрсетті. 2.2 – кестеде кейбір таза металдық
монокристалдардың критикалық сырғанатушы кернеулерінің
шамалары көрсетілген. 2.2 –кесте мәліметтері бойынша ең
пластикалық монокристалдардың критикалық сырғанатушы
кернеуінің  аспайтыны
көрініп тұр. Критикалық сырғанатушы кернеу
кристалдың алдын
ала (предварительная) деформациялану дәрежесіне байланысты, ол
артқан сайын арта түседі. Бұл құбылыс беріктендіру
немесе қақталу деп аталады. Мысалы, магний монокристалының
алдын-ала есе өсуіне алып келеді. Кубтық жүйедегі кристалдар
(алюминий, мыс, никель және т.б.) одан да көп беріктендіруге
ұшырайды. Кристалдардың беріктенуі оларда кристалдағы
атомдар мен жеке бөліктердің бір-біріне қатысты орын
ауыстыруына байланысты болатын қайтымсыз процестердің
өтетіндігін көрсетеді, бұл кристалдың ішкі
энергиясының өзгеруіне алып келеді. Бұл құбылысты
тәжірибе жүзінде зерттеулер пластикалық деформация процесі
кезінде қатты денелердің ішкі энергияларының шын
мәнінде өсетінін көрсетті. 2.3 –кестеде әртүрлі
металдардың деформация процесі кезіндегі энергияларының максималь
шамасы келтірілген. Егер бұл энергия жылуға айналатын болса, онда
ол металды бірнеше градусқа дейін қыздыруға жетер еді.
Кристалдағы пластикалық деформация процесіндегі энергияның
жинақталуы атомдар мен кристалл бөліктерінің бір-біріне
қатысты қайтымсыз ығысуларына байланысты, бұл энергия
негізінен кристалдық тордың бөліктерінің серпімді
сырғанауы кезінде пайда болған қалдық кернеу энергиясы
болып табылады.
аспайтыны
көрініп тұр. Критикалық сырғанатушы кернеу
кристалдың алдын
ала (предварительная) деформациялану дәрежесіне байланысты, ол
артқан сайын арта түседі. Бұл құбылыс беріктендіру
немесе қақталу деп аталады. Мысалы, магний монокристалының
алдын-ала есе өсуіне алып келеді. Кубтық жүйедегі кристалдар
(алюминий, мыс, никель және т.б.) одан да көп беріктендіруге
ұшырайды. Кристалдардың беріктенуі оларда кристалдағы
атомдар мен жеке бөліктердің бір-біріне қатысты орын
ауыстыруына байланысты болатын қайтымсыз процестердің
өтетіндігін көрсетеді, бұл кристалдың ішкі
энергиясының өзгеруіне алып келеді. Бұл құбылысты
тәжірибе жүзінде зерттеулер пластикалық деформация процесі
кезінде қатты денелердің ішкі энергияларының шын
мәнінде өсетінін көрсетті. 2.3 –кестеде әртүрлі
металдардың деформация процесі кезіндегі энергияларының максималь
шамасы келтірілген. Егер бұл энергия жылуға айналатын болса, онда
ол металды бірнеше градусқа дейін қыздыруға жетер еді.
Кристалдағы пластикалық деформация процесіндегі энергияның
жинақталуы атомдар мен кристалл бөліктерінің бір-біріне
қатысты қайтымсыз ығысуларына байланысты, бұл энергия
негізінен кристалдық тордың бөліктерінің серпімді
сырғанауы кезінде пайда болған қалдық кернеу энергиясы
болып табылады.
Суық деформацияланған кристалдың ішкі энергиясының артуы олардың термодинамикалық орнықтылығын азайтады. Бұл кристалда тепе-теңдік күйге келтіруге тырысатын процестердің пайда болуына және жүруіне алып келеді. Осындай процестерге демалыс (отдых) пен рекристализация жатады. Суық деформацияланған кристалдардың ішкі энергиясы оны қақталған күйдегіге қарағанда термодинамикалық орнықтылығын азайтады.
Ығысу болған аймақта орналасқан атомдарды өзінің тепе-теңдік күйіне орналастыру нәтижесінде ішкі кернеулерді біркелкі етіп тарату демалыс деп аталады. Бұл процесс кезінде кристалдың құрылымында айтарлықтай өзгеріс болмайды және пластикалық деформация нәтижесінде пайда болған беріктендіру біраз немесе толығымен жойылады. Диффузиялық процесс болып табылатын демалыс температура мен деформацияның жасырын энергиясына өте тәуелді жылдамдықпен өтеді. Балқу нүктесі төмен металдардың (қорғасын, қалайы, кадмий, цинк және т.б.) тіпті бөлме температурасының өзінде-ақ, өздік деформация жылдамдығы жоғары болады, сондықтан олар біршама жылдамдықпен демалады. Ал осы кезде балқу температурасы жоғары металдардың демалысы бөлме температурасында тіпті болмайды деп алуға болады, бірақ ол температура артқанда бірден тез күшейеді (3150С температурада бұл демалыс 1 минут ішінде өтеді, ал бөлме температурасында болса - оның өту уақыты 100 жыл болар еді). Пластикалық деформация кезінде металдың құрылымы мен механикалық қасиеттерінің артуы наклеп немесе упрочнение деп аталады. Упрочнение – бұл ығысуға кедергі келтірудің артуы, ол майысу деформациясы кезінде тығыздықтың артуына алып келеді. Шамамен металдың балқу температурасының төрттен біріне тең температурада (абсолют шкалада) басқа процесс қарқынды өтеді, ол - наклепталған кристалдың рекристаллизацияға ұшырау процесі. Рекристаллизация кезінде үлгіде ішкі кернеуге тәуелсіз жаңа кристалдар пайда болады. Бұл кристалдардың центрлері ең алдымен артық еркін энергиялары бар тордың ығысқан аймақтарында туындайды. Сонымен, монокристалдың микроструктурасы толығымен өзгеріп, монокристалл поликристалға ауысады. Деформацияланған кристалда жинақталған жасырын энергия рекристаллизация кезінде жылу түрінде бөлінеді.
17.
Кристалдық тордағы ақаулар, соның ішінде нүктелік ақауға анықтама беріңіз.
Нақты кристалдың құрылысы идеалды кристалдың құрылысымен салыстырғанда ақаулы болады. Ақаулар геометриялық тұрғысына қарай нүктелік, сызықтық және беттік, көлемдік ақау болып ажыратылады. Нүктелік ақаулар.Мұндай ақаулардың мөлшері бірнеше атомдар диаметрінен аспайды. Нүктелік ақауларға вакансиялар, орын басу және түйінаралық кірме атомдары жатады (2.5- сурет).
Кинетикалық энергиясы басым атомдар қыздыру үстінде үздіксіз орын ауыстыруда болады. Кейбіреуі беткі қабатқа жетіп жойылып, кейбіреуі түйінаралықта орналасады. Жойылған атомдардың босатқан орнын басқа атомдар басады. Сөйтіп, жылулық вакансиялар түзіледі. Мұндай вакансиялардың пайда болуына түйіршіктің шекаралары, босаған беттер, қуыстар, жарықшалар түрткі болады. вакансия ақаулары қыздырудан ғана емес пластикалық деформация, қайта кристалдану, т.б. өңдеулерден де пайда болуы мүмкін.

1-кірмелі алмасу атомдары; 2,4 – вакансиялар; 3 – кірме ену атомы; 5 – вакансия және түйінаралық ақау; 6 – алмасу және ену атомдары.
2.5 - сурет. Кристалдағы нүктелік ақаулар схемасы
Түйін аралық ақау атомдардың тор түйінін босатып, кристалдардың қуыстарына орналасуынан туады. Тығыз орналасқан торларда түйін аралық ақаудың пайда болуына жұмсалатын энергия жылулық бос орын тудыратын энергиядан жоғары болу керек. Сол себепті металдарда вакансия ақауы көп тараған. Нүктелік ақаулар металл құрамындағы кірмелердің әсерінен де болады. Кірме атомдар негізгі металдың атомдарының орнына немесе түйін аралықта орналасып торды бұзады. Пайда болған бос орын диффузия тудырады. Нүктелік ақаулар металдың электрөткізгіштігіне, магниттігіне, фазалық өзгеруіне әсерін тигізеді.
18.
Кристалдық тордағы ақаулар, соның ішінде сызықтық ақауға анықтама беріңіз. 20. Кристалдық тордағы ақаулар, дислокация және Бюргерс векторы.Сызықтық ақауларға дислокациялар мен түйінаралық атомдардың тізбектері жатады. Олардың өлшемдері бір бағытта микрокристалдың (түйіршіктің) өлшеміндей, ал қалған екі бағытта бірнеше атомаралық қашықтыққа тең.Жалпы анықтама бойынша дислокация деп- кристалл ішіндегі сырғу зонасының шекарасын көрсететін сызықтық ақауды айтады. Мұндай шекара сырғу жазықтығының деформация жүріп өткен бөлігін әлі деформация басталмаған бөлігінен бөліп тұрады.Сызықтық ақаулардың ерекше және маңызды түрлеріне шеттік және бұрандалық дислокациялар жатады.
Шеттік дислокациялар. Тәжірибелер бойынша кез келген жеке микрокристалдың ішінде бірнеше толық емес (демек түйіршіктің бір бетінен екінші бетіне жетпейтін) атомдық жазықтықтар кездеседі. Мұндай жартылай, толық емес атомдық жазықтықтарды – экстражазықтықтар деп атайды (2.6- сурет). Экстражазықтық кристалды иіп, оған сына тәрізді әсер етеді. Экстражазықтықтың төменгі шетінде кристалдық тордың симметриясы бұзылады, демек сызықтық ақау пайда болады. Оның ұзындығы кристалдың ұзындығына тең, ал оған перпендикуляр екі бағытта өлшемдері аз – екіден он атом аралық қашықтыққа дейін жетеді. Осындай экстражазықтық шетінің бойында пайда болатын металдың кристалдық құрылысының сызықтық ақауын – шеттік дислокация деп атайды.

а) шеттік дислокация тудырған сырғу б) шеттік дислокацияның кеңістік схемасы; в, г) дислокация төңірегіндегі атомдардың орналасу схемасы. 2.6- сурет. Шеттік дислокациялар
Экстражазықтықтың шекарасында орналасқан атомдардың координациялық саны кристалдық тордың деформацияланбаған бөлігіндегі санынан аз келеді. Үстіңгі бөліктегі экстражазықтық оң аталып ^ - таңбасымен, төменгі бөліктегі экстражазықтық теріс аталып Т – таңбасымен белгіленеді.Шағын ғана жанама кернеудің әсерінен дислокация оңай орын ауыстырып толық жазықтыққа айналып кетеді де, экстражазықтық міндетін іргелес жазықтықтар атқарады.
Бұрандалық
дислокациялар. Кристалды ABCD
жазықтығы бойымен тіліп, оның алдыңғы оң
жақ бөлігін төмен қарай бір атомдық
арақашықтыққа сырғытайық. Осының
нәтижесінде кристалдың жоғарғы бетінде пайда
болған баспалдақ – оның бүкіл дене бойымен
өтпейді, В нүктесінде бітеді. Жәй куб кристалдың торы
2.7-суретте көрсетілгендей болып өзгереді. Сонымен сырғу
деформациясы нәтижесінде ВС сызығының төңірегінде
металдың атомдық-кристалдық құрылысы
бұзылып, сызықтық ақау пайда болады. Оның бір
өлшемі ВС сызығымен кристалдың биіктігіне тең, ал
қалған екі бағыттағы өлшемдері аз – бірнеше
атомаралық қашықтыққа тең. Мұндай
ақаудың ішінде орналасқан атомдардың
координациялық сандары басқа, атомаралық
қашықтықтары, байланыс энергиялары, қасиеттері
өзгерген.Кристалдық тордың симметриясы мен атомдардың
орналасу реті бұзылған. Ал ВС сызығы сырғу
деформациясы жүріп өткен аймақтың шекарасын
көрсетеді. Сондықтан ВС сызығының бойындағы
бұрандалы баспалдақ тәрізді атомдық
жазықтықтан тұратын кристалдың ақауы –
бұрандалы дислокация деп аталады. 
а) Q – жазықтығының бойындағы толық емес сырғудан пайда болған EF дислокациясы; б) бұрандалы дислокация аймағындағы атомдардың орналасуы.
2.7- сурет. Бұрандалы дислокация
Дислокациялар металдардың кристалдану процесінде, пластикалық деформациялануда және фазалық өзгеру процестерінде пайда болады. Дислокация құрылымының маңызды сипаттамасына дислокация тығыздығы жатады. Дислокация тығыздығы P деп кристалдың бірлік көлеміне U, см3 келетін дислокацияның ұзындық жиынтығы L, см түсіндіріледі.
Сонымен, дислокация тығыздығының өлшем бірлігі, см –2 : P = L/U.
Металл кристалдарында дислокациялар көп мөлшерде (106 – 1012 см2) кездеседі, тез орын ауыстырып отырады және көбеюге бейімді.Металдың механикалық және басқа қасиеттеріне дислокациялардың тек тығыздығы ғана емес металл көлемінде орналасуы да үлкен әсерін тигізеді.
Беттік ақаулар. Беттік ақауларға – кристалдардың сыртқы беті, микрокристалдар мен субкристалдардың (бірнеше блоктан тұратын ірі бөлшектер) шекаралары, жазық дислокациялардағы (БЦК және ГТ торларындағы) атомдардың орналасу ретінің бұзылуы жатады. Кристалл атомдарының ретпен орналасуы бұзылған шекараларында кристалдың қалыңдығынан жұқалтаң (5…10 атом диаметріндей) келетін беттік зона пайда болуы мүмкін. Мұндай ақаулар беттік ақауға жатады. Шекара тұсындағы атомдардың орналасу тәртібінің бұзылуына көбінесе сырттан түскен кірмелердің шоғырлануымен қатар кристалл құрылысының идеальді болмауы әсер етеді. Әрбір кристалл көптеген блоктардан, өлшемі 10-3…10-5 см жеке элементтерден тұратыны анықталған.
19.
Нүктелік ақаулар, Френкель және Шотки бойынша ақаулар. Френкель бойынша дефектілер. Қатты денелер атомдары арасындағы энергияның таралуы газдар мен сұйықтардың молекулалары арасындағы сияқты біркелкі емес. Кез-келген температурада кристалда атомдар бар, олардың энергиялары еркіндік дәреже бойынша біркелкі таралу заңымен анықталатын энергияның орташа мәніне қарағанда бірнеше есе үлкен. Осы мезгілде жеткілікті жоғары энергияға ие атомдар тепе-теңдік маңынан біршама алыстап кетуімен қоса, көршілес атомдар құрған потенциалық тосқауылдан өтіп, жаңа ортаға, басқа ұяшыққа өтіп кетуі мүмкін. Мұндай атомдар өздерінің кристалдық тор түйіндеріндегі орындарын тастап (буланып), түйіндер арасындағы аралықта орналасу мүмкіндігіне ие болады (1.25 а-сурет). Бұл процесс ваканттық түйіндер (вакансия) және түйіндер арасында атомдардың (дислоцирленген атом) пайда болуына алып келеді. Осындай типті торлар Френкель бойынша дефектілер деп аталады.
Есептеулер көрсеткендей берілген температурадағы енген атомдар саны мына қатынаспен анықталады:
 (1.18)
(1.18)
мұндағы
 - ену пайда болуға қажетті энергия,
өлшем бірлігі –электронвольт. N — берілген көлемдегі тор
түйіндерінің саны; А – бүтін сан (әдетте 1-ге
жуық), ол бірлік атомдық торға сәйкес келетін бірдей
түйіндердің санын анықтайды.
- ену пайда болуға қажетті энергия,
өлшем бірлігі –электронвольт. N — берілген көлемдегі тор
түйіндерінің саны; А – бүтін сан (әдетте 1-ге
жуық), ол бірлік атомдық торға сәйкес келетін бірдей
түйіндердің санын анықтайды.
Түйіндер арасындағы атомдар, сонымен бірге вакансиялар бір орында орналасып қалмайды, олар торда диффузияланады. Дислокацияланған атомдардың диффузиясы оның бір түйіндер арасындағы аралықтан екінші аралыққа өтуі, ал вакансияның диффузиясы оны эстафеталық жолмен тізбектей көршілес атомдармен толтырылуы арқылы іске асады (1.25 а-сурет). 1 атомның ваканттық орнына 2-ші атом ауысқанда вакансия 2 түйінге, 3 атом бос 2 түйінге орынға ауысқанда, вакансия 3 түйінге орын ауыстырады және т.б..
Шоттки
бойынша дефектілер. Кристалда ішкі буланулармен қоса, кристалл бетіне
шығып атомдардың толық және жартылай буланулары да
болады. Толық буланғанда атом кристалл бетінен шығып кетіп,
буға айналады (1.25 б-сурет). Жартылай буланғанда атом беттік
қабаттың үстіңгі жағында орналасады (1.25
в-сурет). Екі жағдайда да, кристалдың беттік қабатында
вакансия пайда болады. Вакансияны тереңірек орналасқан атом
басқанда, ол кристалл ішіне қарай тартылады және оның
көлемінде диффузияланады. Бұл вакансияға
дислоцияланған атомдарды қатар қоюға болмайды, себебі
олардың пайда болуы бір мезгілде түйіндер арасындағы
атомдардың орналасуын тудырмайды. Осындай вакансиялар Шоттки бойынша
дефектілер деп аталады. Есептеулер  түйіні
бар кристалда вакансиялардың тепе-тең саны мынаған тең
екендігін көрсетті:
түйіні
бар кристалда вакансиялардың тепе-тең саны мынаған тең
екендігін көрсетті:
 (1.19)
(1.19)
мұндағы
 - вакансия
пайда болатын энергия. Ол
- вакансия
пайда болатын энергия. Ол  -ден
көп кіші, мысалы алюминий үшін 0,75 эВ. Осы мәнді және
-ден
көп кіші, мысалы алюминий үшін 0,75 эВ. Осы мәнді және  деп алып,
(1.19) қойсақ аламыз
деп алып,
(1.19) қойсақ аламыз  .
.  , яғни
алюминийдің балқу температурасына (
, яғни
алюминийдің балқу температурасына ( ) жуық
температурада,
) жуық
температурада,  . Бұл
барлық металдар үшін балқу температурасына жуық
температурада орындалады.
. Бұл
барлық металдар үшін балқу температурасына жуық
температурада орындалады.
Френкель бойынша дефектілердің пайда болу энергиясы вакансия мен дислоцияланған атомдардың пайда болу энергияларының қосындысына тең болады.
Френкель және Шоттки бойынша дефектілер кристалдардағы көптеген процестерге үлкен әсерін тигізеді. Олар ток тасушылардың қозғалғыштығын азайтатын шашырату орталықтары болып табылады. Дефектілер ток тасушылар көзі болып, яғни донор және акцепторлар (әдетте дефектілер акцепторлық әсер етеді) сияқты әсер етуі мүмкін; олар кристалдардың оптикалық, магниттік, механикалық және термодинамикалық қасиеттеріне күшті әсер етеді (оның ішінде әсіресе жұқа жартылай өткізгіштік пленкалар мен ұсақ кристалды үлгілерге).
Қоспалар.
Нақты кристалдар құрылымындағы ең негізгі
және көп тараған дефектілер қоспалар болып табылады.
Қазіргі заманғы тазалау әдістері арқылы абсолют таза
материалдар алу мүмкін емес. Тіпті ең тазаларының
өзінде  қоспалар
болады, ол заттың
қоспалар
болады, ол заттың  көлемінде
көлемінде
 атомдар бар
деген сөз. Осындай заттың тазалық дәрежесін
атомдар бар
деген сөз. Осындай заттың тазалық дәрежесін  бидайда 1
арпа дәнінің болуымен салыстырып көрсетуге болады.
бидайда 1
арпа дәнінің болуымен салыстырып көрсетуге болады.

1.26 – сурет.
Қоспалар табиғатына байланысты кристалда еріген күйде немесе
қандай да бір атомның жанына орналасқан күйде
кездеседі. Еру процесі деп қоспа атомдарының кристалл атомдары
арасында орналасуы немесе тор түйіндеріндегі атомдарды алмастыру деп
түсіну керек. Бірінші жағдайда қатты ерітінді енгізу
ерітіндісі деп (1.26 а –сурет), ал екінші жағдайда орын ауыстыру
ерітіндісі (1.26 в- сурет) деп аталады. Бөтен атомдар
өздерінің физикалық табиғаты жағынан негізгі
кристалл атомдарынан өлшемдері жағынан өзгеше, олардың
болуы кристалл торының ығысуын тудырады.Қоспалар қатты
денелердің химиялық, оптикалық, магниттік және
механикалық қасиеттеріне елеулі әсер етеді. Абсолют
нөлде де жойылмайтын, электрлік кедергіне тудыратын ток тасушыларды
шашырататын эффективті орталық болып табылады. Жартылай өткізгішті
кристалдарда қоспалар жаңа энергетикалық деңгейлер
тудырады және ол қоспалық өткізгіштіктің пайда
болуына алып келеді. Есептеулер көрсеткендей, өте таза
кремнийдің меншікті кедергісі  болуы керек;
ондағы активті қоспалар
болуы керек;
ондағы активті қоспалар  болғанда
меншікті кедергі бірге дейін азаяды. Техникалық таза германийді
өте ұзақ уақыт бойы металл деп келдік, себебі
оның меншікті кедергісі металдардың меншікті кедергісіне
жуық. Тек өте терең тазалау, яғни ондағы
қоспалар үлесін
болғанда
меншікті кедергі бірге дейін азаяды. Техникалық таза германийді
өте ұзақ уақыт бойы металл деп келдік, себебі
оның меншікті кедергісі металдардың меншікті кедергісіне
жуық. Тек өте терең тазалау, яғни ондағы
қоспалар үлесін  жеткізу
арқылы ғана ол кәдімгі жартылай өткізгіш болды.
Қатты денелердің кейбір қызықты қасиеттері
өте таза металдарды зерттеу барысында алынды. Мысалы, темірді
жеткілікті дәрежеге дейін тазалағанда ол химиялық
инерттілікке, тропикалық ылғалдылықтың өзінде де
таттанбайтын қасиетке ие болды. Өте сынғыш келетін титан,
хром, висмут, вольфрам, молибдендерді қоспалардан
жеткізу
арқылы ғана ол кәдімгі жартылай өткізгіш болды.
Қатты денелердің кейбір қызықты қасиеттері
өте таза металдарды зерттеу барысында алынды. Мысалы, темірді
жеткілікті дәрежеге дейін тазалағанда ол химиялық
инерттілікке, тропикалық ылғалдылықтың өзінде де
таттанбайтын қасиетке ие болды. Өте сынғыш келетін титан,
хром, висмут, вольфрам, молибдендерді қоспалардан 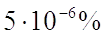 дейін
тазалағанда өте төменгі температураға дейін
суытқанның өзінде де иілгіш, жұмсақтық
қасиетке ие, жұмсақтығы сондай - оны қамыр
сияқты илеуге болады. Заттарды кептіргенде, яғни ылғалды
өте аз мөлшерде қалдырғанда олардың
қасиеттерінің де күшті өзгерістерге ұшырайтыны
тәжірибелер жүзінде алынып, таң қалдырды. Мысалы,
кептірілген қопарғыш газ жоғары температурада жарылмайды,
көміртек окисі оттегіде жанбайды,
күкірт қышқылы сілтілік металдармен өзара
әсерлеспейді және т.б. Ағылшын химигі Бейкер өте
тазартылған 11 затты фосфор ангидридімен (ылғалды бойына
күшті сіңіретін зат) қоса жеке-жеке шыны түтіктерге
салып, дәнекерлеп тастады. Түтіктерді 9 жылдан кейін ылғал
түспейтіндей жағдайда ашты. Нәтиже таң
қаларлық болды: барлық заттардың қайнау
нүктесі бірден жоғарылады. Мысалы, бензолдың қайнау
температурасы кестелік мәннен 26°С, этил спиртінікі 60° С, бромдікі 59°
С, ал сынаптікі жуық шамамен 100° С көтерілді. Кейіннен
жасалған зерттеулер осы нәтижелерді растады. Өте
құрғақ заттардың тек қайнау температурасы
ғана емес, сонымен қоса балқу температурасы мен басқа
қасиеттері де өзгереді. Өте таза заттарды алу жолындағы
жеткен жетістіктерге қарамай, олардың тазалану дәрежесін
арттыруға қойылатын талаптар да күннен-күнге өсіп
келеді. Таяу болашақта құрамындағы қоспалар
үлесі
дейін
тазалағанда өте төменгі температураға дейін
суытқанның өзінде де иілгіш, жұмсақтық
қасиетке ие, жұмсақтығы сондай - оны қамыр
сияқты илеуге болады. Заттарды кептіргенде, яғни ылғалды
өте аз мөлшерде қалдырғанда олардың
қасиеттерінің де күшті өзгерістерге ұшырайтыны
тәжірибелер жүзінде алынып, таң қалдырды. Мысалы,
кептірілген қопарғыш газ жоғары температурада жарылмайды,
көміртек окисі оттегіде жанбайды,
күкірт қышқылы сілтілік металдармен өзара
әсерлеспейді және т.б. Ағылшын химигі Бейкер өте
тазартылған 11 затты фосфор ангидридімен (ылғалды бойына
күшті сіңіретін зат) қоса жеке-жеке шыны түтіктерге
салып, дәнекерлеп тастады. Түтіктерді 9 жылдан кейін ылғал
түспейтіндей жағдайда ашты. Нәтиже таң
қаларлық болды: барлық заттардың қайнау
нүктесі бірден жоғарылады. Мысалы, бензолдың қайнау
температурасы кестелік мәннен 26°С, этил спиртінікі 60° С, бромдікі 59°
С, ал сынаптікі жуық шамамен 100° С көтерілді. Кейіннен
жасалған зерттеулер осы нәтижелерді растады. Өте
құрғақ заттардың тек қайнау температурасы
ғана емес, сонымен қоса балқу температурасы мен басқа
қасиеттері де өзгереді. Өте таза заттарды алу жолындағы
жеткен жетістіктерге қарамай, олардың тазалану дәрежесін
арттыруға қойылатын талаптар да күннен-күнге өсіп
келеді. Таяу болашақта құрамындағы қоспалар
үлесі  болатын
материалдар жасау қажет болады.Бұл ең алдымен
термоядролық синтез қондырғыларында, микроэлектроникада
және басқа да өндіріс орындарында қолданылатын
материалдарға қатысты. Мұндай материалдарды алу ғана
қиын емес, сол алынған материалдардың тазалық
дәрежесін сақтау да өте қиын, әсіресе олар
қолданар алдында қандай да бір өңдеуден өтетін
болса. Осындай заттармен жұмыс жасаған кезде қателікке
қалай тез ұшырауға болатынын көрсету үшін белгілі
неміс физигі Гейзенберг айтқан жағдайды ұсынып отырмыз.
Масс-спектрометрдегі нысананы нейтрондар ағынымен атқылаған
кезде алтын ядроларының пайда болғаны тіркелген. Тәжірибе
жасаушы алтын көзілдірігін шешкен кезде, бұл эффект жоғалып
кеткен.
болатын
материалдар жасау қажет болады.Бұл ең алдымен
термоядролық синтез қондырғыларында, микроэлектроникада
және басқа да өндіріс орындарында қолданылатын
материалдарға қатысты. Мұндай материалдарды алу ғана
қиын емес, сол алынған материалдардың тазалық
дәрежесін сақтау да өте қиын, әсіресе олар
қолданар алдында қандай да бір өңдеуден өтетін
болса. Осындай заттармен жұмыс жасаған кезде қателікке
қалай тез ұшырауға болатынын көрсету үшін белгілі
неміс физигі Гейзенберг айтқан жағдайды ұсынып отырмыз.
Масс-спектрометрдегі нысананы нейтрондар ағынымен атқылаған
кезде алтын ядроларының пайда болғаны тіркелген. Тәжірибе
жасаушы алтын көзілдірігін шешкен кезде, бұл эффект жоғалып
кеткен.
20.
Кристалдық ақаулар нүктелiк, сызықтық және беттiк болып ажыратылады. Нүктелiк ақаудың мөлшерi атомаралық қашықтықпен шамалас. Сызықтық ақаудың ұзындығы енiнен бiрнеше есе артық болады; беттiк ақаудың қалындығы өте жұқа, ал енi мен ұзындығы оның қалындығынан бiрнеше есе артық болып келедi.
Нүктелiк ақаулар. Қарапайым нүктелiк ақауларға: бос орын (вакансия), түйiн аралық атом және қоспа атомдар жатады (2-сурет).
Нүктелiк ақаулар тор iшiнде үздiксiз орын ауыстырып отырады. Бос орынмен көршiлес атом, сол бос орынға ауысып, өз түйiнiн бос қалдыруы мүмкiн. Түйiнге ондайда басқа атом ауысады. Бұл жағдай бос орыннан бiр атомаралық қашықтыққа орын ауыстыруымен пара-пар. Одан әрi процес үздiксiз жаңадан қайталанып отырады. Температура жоғарылаған сайын, бос оындар көбейе түседi әрi олар бiр түйiннен екiншi түйiнге жиi ауысады. Бос орындар маңызды нүктелiк ақау болып есептеледi және олар термиялық активтi процестердi (диффузияны, аса қаныққан қатты ерiтiндiнiң ыдырауын, ұнтақтардың жентектелуiн т.б.) жеделдетедi.
Барлық нүктелiк ақаулар кристалдық торды бұзады, кристалдың электр кедергiсiн артырады және белгiлi бiр дәрежеде кристалды берiк етедi.

2-сурет. Кристалдық тордағы нүктелік ақаулар
Сызықтық ақаулар.Сызықтық ақаудың маңызды түрлерi шеттiк және бұрандалы дислокациялар болып табылады.
Шеттік дислокация – тордағы «артық» жарты жазықтықтың шекарасы:


3-сурет. Сызықтық ақаулар
Дислокацияның маңында тор серпiмдi түрде бұзылады және оның энергиясы жоғарылау болады. Бұзылу өлшемiне Бюргерс векторы деп аталатын шама алынады. Дислокацияның идеал кристалдағы тұйық контур iшiнде бiр түйiннен екiншi түйiнге ауыса отырып, сол контурды айналып шығу процесiн нақты кристалда да қайтайлайтын болсақ, Бюргерс векторы шығады. Нақты кристалдағы контур, 4-суреттен көрiнiп тұрғандай, ашық контур болып келедi. Контурды жабуға керектi вектор Бюргерс векторы деп аталады. Шеттік дислокацияда Бюргерс векторы атомаралық қашықтыққа тең әрi дислокация сызығына перпендикуляр. Бұрандалы дислокацияда да, сондай-ақ Бюргерс векторы атомаралық қашықтыққа тең, бiрақ ол дислокация сызығына параллель болып келедi. Бюргерс векторы дислокацияның сипаттамасы бола алады. Ол дислокацияның энергиясын, қозғалғыштығын т.б. қасиеттерiн анықтайды. Сан шамасы бiр-бiрне тең, бiрақ қарама-қарсы бағытталған Бюргерс векторы бар дислокациялар әр түрлi таңбалы дислокация болып есептеледi. Таңбасы бiрдей дислокациялар бiр-бiрiне тебеді, ал қарама-қарсы таңбалы дислокациялар бір-біріне тартылады.

а-тұйық контур; б-ашық контур.
4-сурет. Бюргерс векторын анықтау
Атомаралық қащықтыққа тең Бюргерс векторлы дислокациялар толық делініп, ал Бюргерс векторы атомаралық қашықтықтан кіші келетін дислокациялар ішінара дилокациялар деп аталады. Толық дислокацияға қарағанда ішінара дислокацияның қозғалғыштығы кемдеу болады.

5-сурет. Бұрандалы дислокация
Беттiк ақаулар. Өнеркәсiпте поликристалды, сондай-ақ монокристалды материалдар пайдаланылады. Алғашқы жағдайда материал мөлшерi өте көп ұсақ кристалдардан (немесе түйiршiктерден) тұрады. Әрбір түйiршiктiң кристаллографиялық жазықтығы әр түрлi бағытталған. Әрбiр кристалл, өз кезегiнде, субтүйiрлерден немесе блоктардан тұрады. Субтүйiршiк – салыстырмалы түрде кристалдың дұрыс құрылған бөлiгi.
Маңызды беттiк ақаулар: түйiршiктер мен субтүйiршiктердiң шекарасы, сондай-ақ жинақтау ақаулары. Ақаудың өлшемi беттiк энергия болып есептеледi.
Түйiршiктердiң шекарасы – енi 10 атом аралық қашықтыққа дейiн баратын ауыспалы аймақ. Бұл аймақта бiр кристалл торы екiншi бiр кристалл торына ауысады. Ауыспалы қабаттың құрылысы күрделi. Ауыспалы қабатта атомдар дұрыс орналаспайды, дислокациялар жиынтығы кездеседi, беттiк энергияны кемiтетiн қоспа концентрациясы да жоғары болады. Түйiршiктер арасындағы шекараны үлкен бұрышты шекара деп атайды, өйткенi көршiлес түйiршiктердiң сәйкес кристаллографиялық бағыттары ондаған градусқа жететiн бұрыш жасайды.
21.
Поликристалдық материадцарда түйіршікгіліктің бар болуы жазық ақаудың білінуінің нақты ақиқатгылығы деуге бола-ды. Поликристалдық дене көптеген бірімен-бірі жалғасқан, қалай бол-са солай бағытталған кристалдардан (түйіршіктерден) түрады (65.8-сурет). Түйіршіктердің арасындағы шекарадағы бөлшекгердің қабатта-ры жазық ақаулардың байқалу аймағы болып табылады. Бүл аймақ-тардың ені бірнеше атом диаметріне тең және көрші өр түрлі бағыттал-ған аймақтардың бір-бірімен түйісуін (жанасуын) қамтамасыз етеді. Көбінесе, поликристалдағы түйіршіктер кристалдың дүрыс пішініне сәйкес келмейді, олардың бетгерінде кездейсоқ бағытталу орын алады. Температура жоғарылап артқан сайын, бөлшектің қозғалғыштығы ар-тады және кейбір түйіршіктер басқатүйіршікгердің есебінен өсе бастайды (екінші рекристаллизация).
Бүл процестің металдар технологиясында үлкен мәні бар. Бүл жерде, ең қызығы, түйіршіктің бар болуы металдың нығайуына (бекуіне) өкеліп соғады (яғни дислокацияның ыкдалының азайуына). Дислокацияның қозғалысьша түйіршіктер ара-сындағы шекара елеулі кедергі болып саналады.
Дислокацияны қоспалар ендіру жолымен бекітеді. Жоғары темпе-ратурада ендірілген қоспалар дислокация аймағында шоғырланады. Төменгі температурада қоспаның атомдары қозғалғыштығын жоғалта-ды және кристалда дислокацияның еркін қозғалуына жол берілмейді.
Кейбір жағдайларда, өте аз қоспаның өзі (0,01 % және одан да аз) 1 дислокацияны бекіту үшін жеткілікті.
Дислокацияны және оның қозғалысын элекгрондық миіфоскоппен бақылауға болады. Әдетгегі кристалдарда, оның бетіндегі дислокация тығыздығы өте үлкен болады.
Түскен күштің әсерінен дененің сырт пішінінің, өлшемдерінің өзгеруі деформация деп аталады. Шағын кернеудің эсерінен туындап, ол кернеуді алып тастағанда бірге жойылатын деформация серпімді, ал сақталып қалатын деформация пластикалық деп аталады. Кернеуді әрі қарай көтергенде туындаған деформация қираумен аяқталуы мүмкін.
Серпімді және пластикалық деформацияның жүру сарыны физикалық тұрғыдан бір-біріне ұқсамайды. Серпімді деформация туындаған металдың микроқүрылымы өзгермейді, кристалл торындағы атомдар тепе-теңдік күйден ауытқып арақашықтықтары өзгереді. Деформация тудырған күшті тоқтатқан кезде орын ауыстырған атомдар бастапқы тепе-теңдік күйіне оралады.
Дененің деформациясы кезінде, дененің бастапқы қалпын мен өлшемін сақтайтын кері күш пайда болады. Бұл күш атом және молекула арасында электромагниттік әсерлесу кезінде пайда болады. Мұндай күшті серпімділік күші деп атайды. Деформацияның қарапайым түрі – созылу және сығылу деформациясы болып табылады
22.
Металдардың электрондық теориясының негізгі қолданушылары Лоренц және Друде ғалымдары. Олардың болжауынша электрондағы электрон тогын тасымалдаушы электрон болып табылады. Олар металл көлемі бойынша еркін қозғала алады. Бұл болжам кейбір фактілерге негізделген. Олардың ішінен екеуін айтып кетейік: қыздырылған металдан электрондардың шығуы (термоэлектрондық эммиссия) және токты инерциялдық қоздыру. Инерция қоздыруға тоқталайық. Егер металдағы электрондар еркін қозғалады деп ескерсек, онда электрондар кристалдық термин байланысты болмайды. Егер металл бүтін ретінде W үдеумен қозғалса, онда инерция салдарынан электрондар торға қатысты W үдеумен қозғалады. Электрондар қозғалған кезде оларға бөгде (қозғаушы) электроқозғаушы күш (Э.Қ.К) әсер еткендей болады:
F=q*E6=-eЕВ
F=m*W, -еЕ6=mW, E6=-mW/e
мұндағы: e- электронның заряды, m- электронның массасы
Металл ішінде электр тогы болады. Ол токтың тығыздығы:
j=6E=-6mW/e (1)
Үдеу болған уақыт ішінде өткізгіштің көлденең қимасынан өткен толық электр зарядын өлшеп, тек тасымалдаушының e/m қатынасынан табуға болады. Толмэн және Стюарт тәжірибесінде бұл қатынас үлкен дәлдікпен еркін электрондық қатынасына жуықтайтын болды. Сонымен тіке өлшеулер арқылы электронның металл ішінде токты тасымалдайтындығы дәлелденді.Металл ішіндегі атомның электрондары әлсіз байланысқан. Крисстал түзілген кезде атомдар арасында өте күшті әсерлесулер кейде ьолады, сонда сыртқы электрондар өздерінің атомдарынан кейін сыртқы электрондар металл ішінде еркін қозғалады.Әрине, металдағы электрондарды толық еркін деп есептеуге болиайды. Керісінше олар металдың оң зарядталған иондармен күшті әсерлесуге түседі. Барлық иондар бір-бірінен белгілі бір арақашықтықта торналасқан (тордың түйіндерінде) ионның қасында (жақындағанда) электрондардың потенциалдық энергиясы минимум шамасына ие болады. Ал электрон екі ионның ортасында орналасқан кезде оның потенциалдық энергиясы максимум мәніне ие болады. Сондықтан электрондардың потенциалдық энергиясы периодты түрде өзгеретін қисық сызық сипатына ие болады.Реал металда электронның потенциалдық энергиясының максимум және минимум бір-бірінен өте аз арақашықтықта (~10-8см) жатады.Электрон өте аз арақашықтықта өткен кезде (мысалы, 1см жол жүрсін) потенциалодық энергиясының максимумы және минимум облыстарын өте көп рет өтеді. Сондай тез тербелетін, потенциалдық энергияны бірінші рет жуықтауға кейбір орташа потенциалдық энергиямен орналастыруға болады. Осы орташа потенциалдық энергия бүкіл кристалл ішінде тұрақты шама деп есептейміз. Осы жуықтауда металдың барлық нүктелерінде потенцалдық энергиясы бірдей мәнге ие болады. Бір нүктеден екінші нүктеге орын ауыстырғанда электрон ешқандай жұмыс жасамайды және бүкіл металдың сыртына шыға алмайды. Металдың сыртына шығу үшін оның кинетикалық энергиасы тереңдігі V0 болатын потенциалдық шұңқырдан көп болуы тиіс. Осындай жуықтауда металл ішіндегі электрондарды ыдыстың ішіндегі газ ретінде ұқсатуға болады. Металл ішіндегі барлық электронның жиынтығы электрондық газ деп атауға болады.Металл ішіндегі жылулық қозғалысқа иондардың металл тербелісін және еркін электрондардың хаосты қозғалыстарын жатқызуға болады. Иондар мен электрондардың қозғалыстары бір-біріне тәуелсіз деп есептесек, оларды олады біз жеке-жеке қарастырамыз. Металл торындағы иондардың жылулық қозғалысы металл емес кристалдық торындағы атомдардың жылулық қозғалысынан ешқандай айырмашылығы жоқ. Сондықтан электрондық газдың қасиеттері мен ғана шектелуге болады. Электрондық газ гипотезаның пайда болу тәжірибелік негізге сүйенетін, классикалық физика тұрғысынан кейбір қиыншылықтарға ұшырады. Егер металлдың әрбір атомы иондалған болса онда электрондық газдың жылу сыйымдылығы
3/2NА*K=KA/моль
тең болуы тиіс.
Сондықтан металдардың толық жылу сыйымдылығы екі құраушыдан тұрады:
Тордың жылу сыйымдылығынан 6KA/моль
Электрондық газдың жылу сыйымдылығынан 3KA/моль
Бірақ, бұл шама 9KAЛ/моль диэлектрик жылу сыйымдылығынан 1,5 есе көп. Ал ол шын мәнінде металл мен диэлектриктердің жылу сыйымдылығы бірдей. Осы сияқты қиыншылықтар металдар үшін жеткілікті. Оларды дұрыс түсіндіру үшін кванттық теория қажет.
23.
Масса m болатын және –е болатын еркін электронды кернеулігі Е болатын электр өрісіне қояйық. Бұл өріс электронға мынадай күшпен әсер етеді:
F=-e*E
Және бұл күш өріске қарсы бағытталған. Ньютонның 2-ші заңына сәйкес электрон үдеуге ие болады :
а = F/m = -eF/m
Бұл күш F және Е өріске қарама-қарсы бағытталған. Егер электронның жылдамдығы v болса, онда оның энергиясы мынаған тең:
E = mv2/2 = p2/2m = h2/8π2m*R2 (1)
мұндағы: P- электронның импульсы. Ол толқындық санмен былай байланысқан:
P = h/2π*R
Енді электронның кристалы периодты өрістегі қозғалысын қарастырайық. Ол электронға сырттан кернеулігі Е болатын өріс әсер етсін. Жоғарыда айтылғандай бұл электронға мынадай күш әсер етеді:
F = -eE
Егер электрон еркін болса, онда оған әсер ететін осы бір ғана күш. Ал периодты өрістегі электронға осы күшпен басқа кристалл өрісінің әсерінен одан да күшті ішкі күш әсер етеді. Содан қорытқы қозғалыс еркін электрон қозғалысынан күрделі болады. Осы қозғалысты қарастырайық. Сыртқы күш F, dt уақыт ішінде әсер еткенде элементар жұмысты табайық dA. Осы dtуақыт ішінде электрон мынандай жол жүреді:
dx=vr*dt
мұндағы: vr =dw/dR-топтық жылдамдық.
dx жолда F күші мынадай элементар жұмыс жасайды:
dA = Fdx = F* Vr *dt
Электрондық толқын үшін циклдік жиілік мынаған тең: W = 2πν = 2πE/h
Мұндағы Е-электрон энергиясының меншікті мәні
Сондықтан топтық жылдамдық мынаған тең:
Vr = dW/dr = 2π/h*dE/dR
dA = F*2π/h*dE/dR*dt = F*2π/h*dE*dt/dR
dA=dE
dE=F*2π/h*dE/dR/dt
dR=F*2π/h
Vr – топтық жылдамдықтан t уақыт бойынша туынды алсақ былай болады:
dVr/dt = 2π/h*d2E/dR2*dR/dt
dV/dt = 4π2/h2*d2E/dR2*F (2)
Осы (2) формула электронның үдеуін күшпен байланысын көрсетеді:
dV/dt=F/h2/4π2/d2E/dR2 (2")
(2") формуласы Ньютонның 2-ші эаңы бойынша былай оқылады. Электрон кристалының ішінде F күштің әсерінен периодты өрісте массасы былай болатын
m* = h2/4π2/d2E/dR (3)
еркін электрн ретінде қозғалады. Осы массасы электронның эффективті массасы деп аталады.
24.



25.
Материалдың магниттік қасиетін талдап, гистерезис тұзағын тұрғызыңыз. Лекция. Заттың магниттік сипаттамалары көп жағдайларда оның диэлектриктік қасиеттерімен дәл келеді. Бағытталған магниттiк поляризация бағытталған диэлектриялық поляризация ұқсас. Тұрақты магниттік диполдері (моменттер) бар атомдар мен молекулалар сияқты, тұрақты электрлік диполдері бар атомдар мен молекулалар да болады. Көптеген материалдар спонтанды магниттелінеді, сол сияқты кейбір заттар спонтанды электрлік моменттерге ие. Осы және басқа көптеген ұқсастықтарына байланысты диэлектриктік және магниттік құбылыстарды зерттеулер қатар жүргізіледі. Заттардың магниттік және электрлік қасиеттері арасындағы ең басты айырмашылықты атап өту керек. Электр зарядтары (монопол) оң және теріс зарядты болады. Магниттік зарядтар болмайды, барлық магнит өрісін тұйық токтар тудырады.
Магниттік материалдар — магниттік қасиетіне сәйкес техникада қолданылуы әр түрлі болатын заттар (негізінен ферро- және ферримагнетиктер). Магниттік материалдардың негізгі көрсеткіштері: В магниттік қанығу индукциясы (немесе қанығу магниттелуі {displaystyle js}),{displaystyle H_{c}} коэрцитивтік күші, m магнит өтімділігі, В_r қалдық магниттік индукциясы, р үлестік электр кедергісі. Коэрцитивтік күшінің шамасына байланысты Магниттік материалдарды шартты түрде жүмсақ магниттік және қатты магниттік материалдар деп бөледі. Магниттік материалдар Негізіндегі құрылғылар тұрақты магнит өрістерін тудыру үшін (тұрақты магниттер), магниттік энергия ағындарын шоғырландыруда (магнитожолдар), магниттік жазба үшін (магниттік таспалар, дискеттер, дискілер), электрондық және иондық шоқтарды қалыптастыруда (магнипік линзалар) берілген фазалық ығысуды, поляризация жазықтығын бұруды, АЖЖ және оптикалық ауқымдағы электромагниттік толқындарды іріктеуді (феррит фаза айналдырғыштар, циркуляторлар, сұзгілер) қамтамасыз етеді. Магниттік қасиет негізінде екі түрге бөлінеді: 1) ферромагнитті, яғни күшті магнитті, 2) парамагнитті, яғни әлсіз магнитті. Әлсіз магниттінің магнит тілінен кері бұрылатын бір түрі бар, оны диимагнит деп атайды. Ферромагниттік қасиеті бар минералдарға жататындар: магнетит (Fе3O4), никельді темір, ферроплатиналардың кейбір түрі. Күкірті аз пирротиндар нашар магниттік қасиеті бар минералдарға жатады. Диамагниттік қасиеті бар минералға тек висмут жатады. Ферромагтниттік қасиеті бар минералдар ішіндегі ең айқыны — магнетит, оның атының өзі сол қасиеті бойынша қойылған. Ол темірдің ұнтағы, түйреуіш, қаламұш, шеге сияқты нәрселерді өзіне тартады.
Жай магнит тіліне әсер етпейтін, бірақ күшті электромагнит аспаппен зерттегенде әлсіз магниттік қасиеті байқалатын минералдар толып жатыр. Осының негізінде электромагнит колдану арқылы минералдарды бір-бірінен ажырататын әдіс те бар. Бұл әдіс минералогиялық лабораторияларда, өндірістік байыту фабрикаларында қолданылады.
26
Н2, О2, N2, және т.б. қосылыстар, сонымен қатар алмаз типті атомдық кристалдардың байланысын иондық және ван-дер-ваальс байланыстары арқылы түсіндіру мүмкін емес. Біртекті атомдар валенттік электрондардың алмасуы нәтижесінде қарама-қарсы зарядталған иондарға айналмайды, металдар мен галойдтардың өзара әсерлесуі де сол сияқты. Екінші жағынан Н2, О2, N2, ... молекулалары арасындағы байланыстың беріктігі Ван-дер-Ваальс күштері әсерінен болатын байланыстан да күштірек. Бұл байланыс коваленттік байланыс деп аталады.
1 .
.
5 –сурет
Осы
күштердің табиғатын түсіну үшін сутегі
молекуласын мысал ретінде аламыз. Бір-бірінен жеткілікті дәрежеде  қашықтықта
сутегінің екі атомы орналассын:
қашықтықта
сутегінің екі атомы орналассын:  ядро мен 1-ші
электроннан тұратын
ядро мен 1-ші
электроннан тұратын  атомы
және
атомы
және  ядро мен 2-ші
электроннан тұратын
ядро мен 2-ші
электроннан тұратын  атомы
(1.5-сурет). Атомдағы электронның күйін сипаттайтын
электрондық бұлтшаның тығыздығы ара
қашықтыққа байланысты өте тез кемиді, 1-ші электронды
атомы
(1.5-сурет). Атомдағы электронның күйін сипаттайтын
электрондық бұлтшаның тығыздығы ара
қашықтыққа байланысты өте тез кемиді, 1-ші электронды
 ядродан, ал
2-ші электронды
ядродан, ал
2-ші электронды  ядродан табу
ықтималдығы өте аз. Есептеулер,
ядродан табу
ықтималдығы өте аз. Есептеулер,  болғанда
әрбір электронның бөгде атомда орташа алғанда
болғанда
әрбір электронның бөгде атомда орташа алғанда  жылда
бір-ақ рет болатынын көрсетті. Сондықтан, А және В
атомдарды оңашаланған атомдар деп алуға болады және
жүйенің энергиясы
жылда
бір-ақ рет болатынын көрсетті. Сондықтан, А және В
атомдарды оңашаланған атомдар деп алуға болады және
жүйенің энергиясы  тең.
Мұндағы
тең.
Мұндағы  -оңашаланған
атомның қалыпты күйдегі энергиясы.
-оңашаланған
атомның қалыпты күйдегі энергиясы.
Атомдар
жақындаған сайын электрондардың бөгде ядроға
ауысу ықтималдылығы арта түседі.  болғанда
бұл атомдардың электрондық бұлтшалары бірін-бірі
күштірек жабады және ауысу жиілігі шамамен алғанда
болғанда
бұл атомдардың электрондық бұлтшалары бірін-бірі
күштірек жабады және ауысу жиілігі шамамен алғанда  дейін
өседі. Ары қарай жақындағанда электрондық
бұлтшалардың бір-бірін жабуы арта береді, кейбір жерлерде
электрондардың өзара ауысу жиілігінің артқаны
соншалық, 1-ші электронның А атомға, ал 2-ші
электронның В атомға тиісті екендігі туралы айтудың
ешқандай мағынасы болмайды. Бұл жаңа күйдің
пайда болғанын көрсетеді, оңашаланған атомдардағы
электрондар енді бір мезгілде екі атомға да тиісті немесе басқаша
айтқанда біріккен.
дейін
өседі. Ары қарай жақындағанда электрондық
бұлтшалардың бір-бірін жабуы арта береді, кейбір жерлерде
электрондардың өзара ауысу жиілігінің артқаны
соншалық, 1-ші электронның А атомға, ал 2-ші
электронның В атомға тиісті екендігі туралы айтудың
ешқандай мағынасы болмайды. Бұл жаңа күйдің
пайда болғанын көрсетеді, оңашаланған атомдардағы
электрондар енді бір мезгілде екі атомға да тиісті немесе басқаша
айтқанда біріккен.
Электрондардың
бірігуі электрондық тығыздық  және
жүйе энергиясы өзгерісін тудырады. 1.6-суретте 1-ші үзік
сызықпен оңашаланған атомдардағы электрондық
бұлтшалардың тығыздығы, ал 2-ші жіңішке
сызықпен оңашаланған атомдардың электрондық
бұлтшаларын қарапайым қосқан кездегі
қорытқы тығыздық, ал 3-ші қою сызықпен
және
жүйе энергиясы өзгерісін тудырады. 1.6-суретте 1-ші үзік
сызықпен оңашаланған атомдардағы электрондық
бұлтшалардың тығыздығы, ал 2-ші жіңішке
сызықпен оңашаланған атомдардың электрондық
бұлтшаларын қарапайым қосқан кездегі
қорытқы тығыздық, ал 3-ші қою сызықпен  ядро мен
ядро мен  ядро
қосылған кездегі ось бойындағы тығыздықтың
таралуы көрсетілген.
ядро
қосылған кездегі ось бойындағы тығыздықтың
таралуы көрсетілген.
Cуреттен электрондар біріккенде электрондық бұлтшалардың ядролар арасындағы кеңістікке қарай тартылатыны көрініп тұр: ядродан алыс емес қашықтықтағы кеңістік бұлтшасының тығыздығы оңашаланған атомдағы тығыздыққа қарағанда азаяды, ал осы кезде ядролар арасындағы кеңістікте ол қорытқы тығыздыққа қарағанда артады. Қорытқы тығыздықты осы кеңістікте оңашаланған атомдар тығыздығын қосып алуға болар еді.

1.6 – сурет
Ядро аралық кеңістіктегі электрондық бұлтша тығыздығы жоғары күйдің пайда болуы әрқашан да жүйе энергиясының кемуіне және бұл атомдар арасында тартылыс күштерінің пайда болуына алып келеді. Басқаша сөзбен айтқанда, біріккен атомдар жұптарынан тұратын ядро аралық кеңістіктегі электрондық бұлтша ядроларды өзіне тартып, оларды бір-біріне максимал жақындатуға тырысады. Бұл коваленттік байланыстың пайда болуын көрсетеді.
Сутегі молекуласын ең алғаш рет сандық түрде есептеген 1927 жылы Гейтлер мен Лондон болды. Бұл есептеулер екі жақын орналасқан сутегі атомынан тұратын жүйенің энергиясы спиндерінің бағытына байланысты екі мәнге ие болуы мүмкін екендігін көрсетті:
 (1.11)
(1.11)
Спиндері қарама-қарсы бағытталса осындай, ал параллель бағытталса мына түрде болады:
 (1.12)
(1.12)
Мұндағы 2Е0 - екі оңашаланған сутегі атомының қорытқы энергиясы,
К – электрондардың ядролармен, электрондардың бір-бірімен және

1.7 – сурет
ядролардың бір-бірімен өзара әсерлесулерінің электростатикалық энергиялары. Оны сонымен бірге, Кулон энергиясы деп те атайды, таңбасы теріс. А – атомдардың электрондармен алмасқан кезде пайда болған өзара алмасу энергиясы. Бұл атомдардың электрондық тығыздықтарының қайтадан таралып молекула құрылған кезде пайда болатын қосымша энергия; оның таңбасы теріс, абсолют шамасы жағынан К-дан көп үлкен К (|А | > | К |); S — неортогональ интеграл деп аталады, оның шамасы мына аралықта жатады: 0≤S≤1.
 энергиясы бар
күй - симметриялы, ал
энергиясы бар
күй - симметриялы, ал  энергиясы бар
күй- антисимметриялы. К мен А теріс таңбалы, ал
энергиясы бар
күй- антисимметриялы. К мен А теріс таңбалы, ал  болғандықтан,
симметриялы күй пайда болғанда жүйе энергиясы екі
оңашаланған атомдар энергиясына
қарағанда кемиді:
болғандықтан,
симметриялы күй пайда болғанда жүйе энергиясы екі
оңашаланған атомдар энергиясына
қарағанда кемиді:  (1.13)Бұл
тартылыстың пайда болуына сәйкес келеді. Соның салдарынан
алмасу энергиясының абсолют шамасы А кулондық энергия К-дан
жеткілікті дәрежеде көп болады, жүйенің
энергиясының кемуі негізінен А есебінен болады. Сондықтан, атомдар
арасында пайда болатын тартылыс күшін алмасу күші немесе алмасу
энергиясы деп атайды. Сол себепті,
(1.13)Бұл
тартылыстың пайда болуына сәйкес келеді. Соның салдарынан
алмасу энергиясының абсолют шамасы А кулондық энергия К-дан
жеткілікті дәрежеде көп болады, жүйенің
энергиясының кемуі негізінен А есебінен болады. Сондықтан, атомдар
арасында пайда болатын тартылыс күшін алмасу күші немесе алмасу
энергиясы деп атайды. Сол себепті,  болса,
яғни антисимметриялы күй пайда болғанда жүйе энергиясы
артады. Бұл тебіліс күшінің пайда болуына алып келеді.
болса,
яғни антисимметриялы күй пайда болғанда жүйе энергиясы
артады. Бұл тебіліс күшінің пайда болуына алып келеді.
1.7 –суретте  пен
пен  -дің
-дің  шамасына
тәуелділігі кескінделген, мұндағы
шамасына
тәуелділігі кескінделген, мұндағы  -
атомдардың ара қашықтығы,
-
атомдардың ара қашықтығы,  - бірінші Бор
орбитасының радиусы. Энергияның нөлдік деңгейін
- бірінші Бор
орбитасының радиусы. Энергияның нөлдік деңгейін  -ден бастап алу келісілген.
Суреттен көрініп тұрғандай, антисимметриялы күйде
жүйенің энергиясы атомдар жақындай бастағанда
үзіліссіз түрде өседі, ол атомдардың бірін-бірі тебуіне
сәйкес келеді (1 -қисық). Сондықтан, бұл
күйде сутегі молекуласы түзіле алмайды. Симметриялы күйде
-ден бастап алу келісілген.
Суреттен көрініп тұрғандай, антисимметриялы күйде
жүйенің энергиясы атомдар жақындай бастағанда
үзіліссіз түрде өседі, ол атомдардың бірін-бірі тебуіне
сәйкес келеді (1 -қисық). Сондықтан, бұл
күйде сутегі молекуласы түзіле алмайды. Симметриялы күйде  кеміген сайын,
жүйе энергиясы да алғашында кемиді және
кеміген сайын,
жүйе энергиясы да алғашында кемиді және 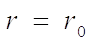 болғанда
өзінің минималь мәніне жетеді. Ары қарай
болғанда
өзінің минималь мәніне жетеді. Ары қарай  кеміген сайын
энергия арта бастайды да, күшті тебіліс күштері пайда болады.
Потенциалық энергия қисығында минимумның бар болуы
орнықты жүйенің мүмкіндігін, яғни сутегі
молекуласының пайда болуын көрсетеді. Бұл жүйені
бұзу үшін потенциалық шұңқырдың
тереңдігі
кеміген сайын
энергия арта бастайды да, күшті тебіліс күштері пайда болады.
Потенциалық энергия қисығында минимумның бар болуы
орнықты жүйенің мүмкіндігін, яғни сутегі
молекуласының пайда болуын көрсетеді. Бұл жүйені
бұзу үшін потенциалық шұңқырдың
тереңдігі  -ке тең
жұмыс жасау қажет.
-ке тең
жұмыс жасау қажет.
|
Газ |
|
Кристалл |
|
|
Көміртек
окисі |
10,8 |
Алмаз |
6,8 |
|
Азот |
9,5 |
Кремний
|
4,4 |
|
Оттегі
|
5,0 |
Германий
|
3,5 |
|
Сутек |
4,4 |
Теориялық
есептеулер арқылы алынған  және
және  мәндері:
мәндері:  ,
,  ; Осы
шамалардың тәжірибе жолымен алынған мәндері:
; Осы
шамалардың тәжірибе жолымен алынған мәндері:  ,
,  .
Теориялық және тәжірибелік мәндер бір-бірімен
сәйкес келеді.
.
Теориялық және тәжірибелік мәндер бір-бірімен
сәйкес келеді.
1.4 – кестеде кейбір коваленттік байланыстар - H2, N2, О2, СО молекулаларының, сонымен бірге алмаз, кремний және германий кристалдарының байланыс энергиялары берілген (байланыс коваленттік күштермен іске асады).
1.4 – кестедегі
мәндерден коваленттік байланыстың өте күшті екендігі
көрініп тұр: байланыс энергиясы  -ге дейін
жетеді. Коваленттік байланыстың басқа байланыс түрлерінен
сипаттамалық ерекшеліктері – қанығушылық және
бағытталғандық болып табылады.
-ге дейін
жетеді. Коваленттік байланыстың басқа байланыс түрлерінен
сипаттамалық ерекшеліктері – қанығушылық және
бағытталғандық болып табылады.
Қанығушылық, яғни әрбір атом тек өзімен көршілес белгілі бір атомдармен ғана коваленттік байланыс құра алады деген сөз.
Сутегінің әрбір атомы тек қана өзімен көршілес бір ғана атоммен байланыс жасай алады. Осы байланыс түзетін атомдар жұбының спиндері антипараллель және бір кванттық ұяшықта орналасады. Бұл жағдайда үшінші атом тартылмайды, тебіледі.
Валенттік электрон орналасқан электрондық бұлтшаның тығыздау бөлігіне сәйкес келетін бағытта валенттік байланыс пайда болады. Бұл кезде байланысқан электрондар бұлтшаларының максималь жабылуы болады. Ол валенттік байланыстың бағыттаушы сипаты бар екенін көрсетеді.
27
Химиялық байланыс - атомдардың бір-бірімен жай және күрделі заттар түзіп қосылатынын айтамыз. Онда әр түрлі химиялық байланыс түзіледі: ионды, ковалентті (полюсті және полюссіз), металдық және сутектік. Атомдар арасында ионды немесе ковалентті байланыстың қайсысы түзілетінін анықтайтын элемент атомдарының ең негізгі қасиеттерінің бірі - терісэлектрлік, яғни атомдардың қосылыстарда өзіне электрондарды тарту бейімділігі. Теріс электрліктің шартты сан мәнін салыстырмалы терісэлектрлік шкаласы береді.
Периодтарда элементтердің терісэлектрлігі жалпы өсу теңценциясы байқалады, ал топтарда - ол кемиді. Элементтерді терісэлектрлігі бойынша қатарға орналастырады, оның негізінде әр түрлі периодта болатын элементтердің терісэлектрлігін салыстыруға болады.
Химиялық байланыс түрлері қосылысатын элемент атомдарының теріс электрлік шамаларының айырмасы қанша үлкен болатынына тәуелді. Байланыс түзуші элемент атомдарының теріс электрлігінің айырмасы қанша үлкен болса, химиялық байланыс соғүрлым полюсті болады. Химиялық байланыс типтерінің арасында бірден бөліп, шек жүргізіп тастауға болмайды. Көптеген қосылыстарда химиялық байланыс түрлері аралық болады. Мысалы, күшті полюсті ковалентті химиялық байланыс ионды байланысқа жақын. Химиялық байланыс өз сипаты бойынша шекті жағдайдың қайсысына жақын болса, оны не ионды, не ковалентті полюсті байланысқа жатқызады.
Барлык байланыстардын ішіндегі ен көп тарағаны - Ван-дер-Ваальс байланысы болып табылады. Сонымен бірге, ол ен әлсіз байланыс, онын энергнясы 104 Дж / моль . Таза күйінде бұл байланыс шікі электрондык кабыкшалары толтырылған бейтарап атомдар мен молекулалар өзара әсерлескенде байкалады. Ван-дер-Ваальс күштері инертті газдардын, сутегі, оттегі. азот және көптеген органпкалык. бейорганикалык косылыстардын сұпык және катты күпде болуын, валенттік молекулалык кристалдардын үлкен тобының байланысын камтамасыз етеді. Ван-дер-Ваальс байланысынын энергиясы өте аз, ол орныкты емес, сондыктан оған негізделген барлык күрылымдар тез үшып кетеді және кайнау нүктесі төмен болады.
28.
Иондық байланыс катиондар мен аниондардың арасында электро-статикалық тартылу күшінің нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8 электронды тұрақты октет қабатқа ие болып, катион мен анионға айналу үшін олар күшті металдар мен бейметалдарға жатуы тиіс.
Иондық байланысқан қатты заттар иондық кристалдық торға ие болады. Сондықтан олар қатты, берік, қиын балқитын заттарға жатады. Иондық байланыс көбіне нағыз типтік металдардың оксидтері мен гидроксидтеріне және барлық тұздарға тән.
Әдетте, бір молекуланың ішінде байланыстың әр түрлі типтері кездеседі. Мысалы, күшті негіздерде (КОН, Са(ОН)2, т.б. ) металл катионы мен гидроксотоп арасында иондық, ал оттек пен сутек арасында коваленттік полюсті байланыс түзіледі. Оттекті қышқылдардың тұздарында да (K2SО4, СаСО3, т.б.) металл катионы қышқыл қалдығының анионымен иондық байланыспен байланысса, оттек пен бейметалл (С, S) арасында коваленттік полюсті байланыс түзіледі.
Жалпы алғанда, химиялық байланысты типтерге жіктеу шартты сипатқа ие. Өйткені олардың түпкі негізі бір. Мысалы, иондық байланысты коваленттік байланыстың шекті түрі деп қарау керек. Металдық байланыста коваленттік полюсті байланыстың да, иондық байланыстың да элементтері бар. Көптеген заттарда "таза" бір ғана химиялық байланыс типі бола бермейді. Мысалы, ас тұзы — натрий хлориді иондық байланысты қосылыстарға жатады. Іс жүзінде оның 84% байланысы иондыққа, қалған 16%-і коваленттіге тиесілі. Сондықтан химиялық байланыстың полюстік дәрежесін біліп тұрып, нақты қай типке жататынын сөз еткен дұрыс.
Егер галогенсутектер қатарындағы байланыстың полюстік дәрежесінің өзгеруіне келсек, фторсутектен астатсутекке қарай: HF→HCl→HBr→HI→HAt төмендейді. Себебі галоген мен сутектің электртерістіктерінің айырмашылығы азая түседі де, ақыры астатсутекке жеткенде байланыс полюссіз коваленттіге жуықтайды.
Химиялық байланыстың барлық типтері мен түрлерінің негізі бір болатыны — олардың бәрінің де табиғаты электрондық бұлттардың тығыздығының өзгеруіне тәуелді. Химиялық байланыстың түзілуі кез келген жағдайда электрондық-ядролық әрекеттесудің арқасында, осы кездегі энергия ұтысының (бөлінуінің) нәтижесінде іске асады. Оны барлық химиялық байланыс типтерінің белгілерін өзара салыстырғанда байқаймыз.
Маделунг тұрақтысы - иондық кристалды торларда электростатикалық потенциалды кристалдық тор параметрiмен байланыстыратын шама. Эрвин Маделунгке арналып аталған.
Иондық кристалдағы бір Ei ионының электростатикалық әсерлесу энергиясын:


i және jиондар
арасындағы қашықтығы: rij = ri -
rj,
zj - j ионының заряды; е - электронның
заряды;  0-электр
тұрақтысы.
0-электр
тұрақтысы.

M - Маделунг тұрақтысы.
Иондарының заряды  NaCl кристалды
торы үшiн Маделунг тұрақтысы:
NaCl кристалды
торы үшiн Маделунг тұрақтысы:


29.
Металдық байланысты түсіндіретін теорияға талдау жасаңыз. Менделеев кестесінің әрбір периодының басында тұрған металдар ерекше денелер тобын құрайды. Металдық байланыстың пайда болуын иондық және коваленттік байланыстар тұрғысынан түсіндіру мүмкін емес. Шын мәнінде иондық байланыс металл және галоидтар атомдары арасында, яғни қосымша электрон қосып немесе беріп жібере алатын атомдар арасында пайда болады. Мұндай байланыс металдардың біртекті атомдары арасында бола алмайды. Екінші жағынан, металл атомдарының көршілес атомдармен валенттік байланыс жасауға қажетті электрондары жоқ. Мысалы, мыс атомының бір ғана валенттік электроны бар және бір атоммен валенттік байланыс жасай алады. Мыстың кристалдық торында әрбір атом он екі көршілес атомдармен қоршалған, ол олармен күштік байланыста болуы керек. Бұл, металдарда ерекше байланыс күштерінің бар екендігін көрсетеді, оны металдық байланыс деп атайды. Осы күштің табиғатын қарастырайық.
 1.8 -сурет
1.8 -сурет
Металл атомындағы сыртқы валенттік электрондар ядромен нашар байланысқан. Сұйық және қатты күйде атомдардың бір-біріне жақын орналасатыны соншалық, валенттік электрондар өздерінің атомдарын тастап, кристалдық тор ішінде емін-еркін қозғалып жүреді. Сонымен, металдың кристалдық торында теріс зарядтың біртекті таралуы байқалады. Ол тікелей тәжірибелер барысында дәлелденген. Мысал ретінде 1.8-суретте рентгенографиялық әдіспен алынған алюминийдің кристалл торлары түйіндері арасындағы электрондық тығыздықтың тәжірибелік таралу қисығы көрсетілген. Түйіндер арасындағы кеңістіктің басым бөлігінде электрондық тығыздық тұрақты түрде сақталады. Тек қана түйіндерде ол алюминий атомының ішкі бұлтшалары есебінен күрт артады.Металл торларындағы байланыс оң иондардың электрондық газбен өзара әсерлесуі нәтижесінде пайда болады. Олардың арасында тұрған электрондар оларды өздеріне тартып, аттас зарядталған иондар арасындағы тебіліс күштерін теңестіруге тырысады. Иондар арасындағы ара қашықтық азайған сайын электрондық газдың тығыздығы артады, соның нәтижесінде иондарды тартушы күш те артады. Екінші жағынан, иондар арасындағы ара қашықтық азайған сайын, иондарды бір-бірінен алыстатуға тырысатын тебіліс күштері артады. Тартылыс күші мен тебіліс күштері тепе-теңдікте болатын ара қашықтыққа жеткенде тор орнықты болады. Металдық байланыс пен валенттік байланыс арасында ұқсастық бар, себебі екеуінің де негізі сыртқы валенттік электрондардың бірігуінде жатыр. Бірақ та, валенттік байланыста көршілес атомдар болып табылатын атомдар жұбы электрондары бірігеді, бұл электрондар үнемі атомдар арасында, ал металдық байланыс кезінде кристалдың барлық атомдарындағы электрондар бірігеді және олар тор ішінде еркін қозғалып жүреді.
30.
Диэлектирик материалдардың активті және пассивті қасиеттерін ашыңыз.
Диэлектриктер – электрөткізгіштігі аз заттар, себебі олардың еркін зарядталған бөлшектері – электрондар және иондар аз. Бұл бөлшектер диэлектриктерде тек жоғары температураларда ғана пайда болады. Диэлектриктер газтәріздес (газдар, ауа), сұйық (майлар, сұйық органикалық заттар) және қатты (парафин, полиэтилен, тасқабат, керамика және т.б.) болып келеді.
Диэлектрик — поляризацияға қабілеттілігі негізгі электрлік қасиеті болып табылатын, металдар мен жартылайөткізгіштерге қарағанда электр тогын нашар өткізетін, үлестік электр кедергісі өте үлкен (106- 1016 Ом • м) қатты, сұйық және газ тәріздес заттар.
Газ тәрізді диэлектриктер туралы негізгі мәліметтер Газ тәрізді диэлектриктерге барлық газдар және ауа жатады. Көптеген газдарды газ толтырылған конденсаторларда, жоғары кернеуліктегі ауа ажыратқыштарда және басқа электртехникалық қондырғыларда диэлектриктер ретінде қолданады. Ауа барлық электрлік қондырғыларды айнала қоршайды және диэлектрик сияқты олардың жұмысының сенімділігін анықтайды. Сол сияқты, фарфорлы немесе әйнекті изоляторлар көмегімен діңгекке бекітілген жоғары кернеуліктегі электрбергіш сым тораптары бір-бірінен ауа қатпарымен оқшауланған. Кейде ауа қатпарында ашық күлгін жарық - электрлік тәж бақыланады. Электрлік тәж ауаның электризоляциялық қасиеттерінің нашарлауы барысында немесе жоғары кернеуде ауаның әрекет етуі барысында пайда болады және энергияның шығынына әкеледі.
Диэлектриктерде зарядталған еркін бөлшектер жок. Дегенмен, электр өpiciнiң әсерінен диэлектрик молекулаларының құрамына кіретін оң бөлшектер өpic бағытымен, ал тepic бөлшектер өpicкe қарсы жылжиды, сөйтіп әpбip молекула поляризацияланады (полюстер алады). Осының салдарынан диэлектриктің өpicінeн бағыттас жағы оң, қарама-қарсы жағы тepic зарядталады. Бұл құбылысты диэлектриктің поляризациялануы деп атайды.
Поляризациялану тypiнe қарай диэлектрик eкі топқа бөлінеді: активті және пассивті. Активті диэлектриктерге сегнетоэлектриктер, пьезоэлектриктер мен электриктер жатады. Қалган диэлектриктер пассивті деп аталады.
Сегнетоэлектриктер — белгілі температуралар аралығында (сегнетоэлектрлік фазаға сәйкес) бағыты сыртқы әсерлер арқылы (электр өрісімен немесе механикалық кернеулермен) өзгертіле алатын спонтанды поляризацияланған кристалл диэлектриктер (соның ішінде сұйық кристаллы).
Пьезоэлектрик - механикалық кернеулер әсерінен поляризацияланатын (тура пьезоэлектрлік эффект), берілген сыртқы электр өрісі әсерінен деформацияланатын (кері пьезоэлектрлік эффект) кристаллы диэлектрик. Пьезоэлектрикке сегнет тұзы, барий титанаты, пьезокварц монокристалдары және әр түрлі қосылыстардағы электреттер жатады. Электроникада пьезоэлектри электромеханикалык және электроакустикалық түрлендіргіштерді, жолакты электрсүзгілерін, жиілікті тұрақтандырудың резонаторларын жасау үшін қолданылады.
Электреттер - сыртқы әсерді жойғаннан кейін ұзақ уақыт бойы поляризацияланған күйді сақтайды























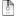 (zip - application/zip)
(zip - application/zip)