БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФИЗИЧЕСКИЙ ФАКУЛЬТЕТ
Реферат
«Спектры элементов 1-ой группы таблицы Менделеева»
Студента 3 курса 1 группы
Мацуковича Антона
Минск 2013
В первую группу таблицы Менделеева входят щелочные металлы Li, Na, K, Rb, Cs, и Fr, а также Cu, Ag и Au.
1. Схема термов щелочных элементов.
Электронные оболочки щелочных металлов имеют одинаковое строение – вне заполненных оболочек находится один электрон в состоянии ns. Основным термом является терм  . Заполненные оболочки очень прочны, так как их строение такое же, как и у атомов благородных газов. По этой причине спектры атомов щелочных металлов определяются исключительно переходом внешнего, наиболее слабо связанного электрона. Эффективное поле, в котором движется этот электрон, центрально-симметрично, поскольку заполненные оболочки всегда имеют равные нулю полный орбитальный момент и полный спин. На больших расстояниях эффективное поле совпадает с кулоновским полем заряда e, так как электроны замкнутых оболочек экранируют поле ядра. На малых расстояниях (вблизи ядра) экранировка не имеет места, и роль заполненных оболочек сводится к созданию некоторого постоянного потенциала. Таким образом,
. Заполненные оболочки очень прочны, так как их строение такое же, как и у атомов благородных газов. По этой причине спектры атомов щелочных металлов определяются исключительно переходом внешнего, наиболее слабо связанного электрона. Эффективное поле, в котором движется этот электрон, центрально-симметрично, поскольку заполненные оболочки всегда имеют равные нулю полный орбитальный момент и полный спин. На больших расстояниях эффективное поле совпадает с кулоновским полем заряда e, так как электроны замкнутых оболочек экранируют поле ядра. На малых расстояниях (вблизи ядра) экранировка не имеет места, и роль заполненных оболочек сводится к созданию некоторого постоянного потенциала. Таким образом,

 -
- r
r ;
; 
 -Z
-Z r
r .
.
Поскольку на всех расстояниях кривая  лежит ниже кулоновского потенциала -
лежит ниже кулоновского потенциала - , уровень n, l лежит ниже соответсвующего уровня атом водорода
, уровень n, l лежит ниже соответсвующего уровня атом водорода
E
 .
.
Чем дальше от заполненных оболочек находится электрон, тем более водородоподобно поле. Поэтому при больших n, l можно ожидать, что система уровней будет близка к водородной.
Изложенные общие соображения подтверждаются экспериментальными данными. На рис.1 приводятся схемы термов
Li, Na, K, Rb и Cs.
Рис.1
 |
Пунктиром нанесены соответствующие водородные термы. Схема термов Li при малых n и l существенно отличается от водородной. Прежде всего имеет место типичное для водорода вырождение по l. С увеличением n и l термы все больше совпадают с водородными. Расстояние между уровнями
 и
и  уменьшается с увеличением n и l. При данном n уровни тем более водородоподобны, чем больше l. Эта зависимость имеет простой физический смысл. В среднем оптический электрон в состоянии n, l тем больше времени находится на больших расстояниях от ядра, где поле близко к кулоновскому, чем больше l.
уменьшается с увеличением n и l. При данном n уровни тем более водородоподобны, чем больше l. Эта зависимость имеет простой физический смысл. В среднем оптический электрон в состоянии n, l тем больше времени находится на больших расстояниях от ядра, где поле близко к кулоновскому, чем больше l. У Na отличие поля от кулоновского проявляется еще сильнее, чем у Li. Расположение нижних уровней еще больше отличается от того, которое характерно для водорода. Так, уровень 4s лежит ниже, чем 3d.
Аналогичная картина имеет место и у Rb. Уровни 5s и 5p лежат значительно ниже уровней 4d и 4f. При больших n и l, так же как и в случае Li, водородоподобность восстанавливается.
Термы атомов щелочных металлов по аналогии с водородом принято описывать формулой
 , (3)
, (3)
где  -эффективное главное квантовое число, которое подбирается так, чтобы удовлетворить экспериментальным данным. Сравнение (3) с экспериментом показывает, что
-эффективное главное квантовое число, которое подбирается так, чтобы удовлетворить экспериментальным данным. Сравнение (3) с экспериментом показывает, что  с хорошей точностью можно представить в виде разности
с хорошей точностью можно представить в виде разности
 , (4)
, (4)
где  , так называемая поправка Ридберга, или квантовый деффект, не зависит от n. Зависимость
, так называемая поправка Ридберга, или квантовый деффект, не зависит от n. Зависимость  от l показана на рис.2.
от l показана на рис.2.
 |
Рис.2
Во всех случаях f-состояния полностью водородоподобны. Даже для Cs, которому соответсвуют наибольшие значения  , при l=3
, при l=3  =0. В таблице 1 в качестве примера приводятся значения
=0. В таблице 1 в качестве примера приводятся значения  для Na.
для Na.
Таблица 1
 |
Существенно, что наименьшее из значения  всегда больше единицы. Например, для Na
всегда больше единицы. Например, для Na  =1,627, для Rb
=1,627, для Rb  =1,8 и т.д. Поэтому потенциалы ионизации
=1,8 и т.д. Поэтому потенциалы ионизации  и резонансные потенциалы
и резонансные потенциалы  щелочных металлов значительно меньше, чем у водорода.
щелочных металлов значительно меньше, чем у водорода.
2. Сериальные закономерности.
При рассмотрении спектров щелочных элементов на первый взгляд трудно обнаружить сериальные закономерности. Детальный анализ, однако, позволяет выделить ряд серий того же типа, что и у водорода. Трудность выделения серий в спектрах атомов щелочных металлов связана с тем, что в видимой области спектра ряд серий накладывается друг на друга.
Основными являются следующие четыре серии: главная – переходы между основным S-термом и P-термами, резкая – переходы между наиболее глубоким P-термом и расположенными выше S-термами, диффузная – переходы между наиболее глубоким P-термом и D-термами, фундаментальная – переходы между наиболее глубоким D-термом и F-термами.
Кроме этих, имеется ряд других, соответствующих переходам между более высокими термами. Эти серии попадают уже в инфракрасную область. Для Li, например, имеем
2sS-npP главная серия,
2pP-nsS резкая серия,
2pP-ndD диффузная серия,
3dD-nfF фундаментальная серия,
3sS-npP; 3pP-nsS; 3pP-ndD и т.д.
Переходами  исчерпываются все переходы, разрешенные правилами отбора
исчерпываются все переходы, разрешенные правилами отбора  четный терм-нечетный терм.
четный терм-нечетный терм.
Общая формула для спектральных серий щелочных элементов согласно (3) имеет вид

Резкую серию также называют первой побочной, диффузную – второй побочной и фундаментальную – серией Бергмана.
Спектроскопическое обозначение состояний l=0, 1, 2, 3 берет свое начало от наименования серий в спектрах щелочных элементов. Буквы s, p, d, f являются начальными буквами названий серий s-sharp-резкая, p – principal-главная, d-diffuse-диффузная и f-fundamental-фундаментальная.
3.Тонкая структура спектров щелочных элементов.
Мультиплетность термов в данном случае равна двум. Поэтому все термы, за исключением  , дублетны. Термы
, дублетны. Термы  - синглетны. Таким образом, имеем следующие термы:
- синглетны. Таким образом, имеем следующие термы:

Как правило, в спектрах щелочных элементов расположение компонент дуплетов нормальное - уровень j=1/2 лежит ниже уровня j=3/2, уровень j=3/2 – ниже j=5/2. Имеются и исключения. В спектрах некоторых щелочных элементов ряд термов  и
и представляют собой обращенные мультиплеты.
представляют собой обращенные мультиплеты.
В таблице 2 приводятся значения расщеплений первых возбужденных  - термов атомов Li, Na, K, Rb и Cs.(
- термов атомов Li, Na, K, Rb и Cs.( ).
).
Таблица 2
 |
Как видно из таблицы, величина расщепления первого возбужденного  - терма резко возрастает с увеличением порядкового номера атомы Z. Это связано со следующим обстоятельством. У водорода дублетное расщепление пропорционально
- терма резко возрастает с увеличением порядкового номера атомы Z. Это связано со следующим обстоятельством. У водорода дублетное расщепление пропорционально 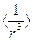 , т.е. определяется областью малых значений r; то же имеет место для щелочных элементов. Но на малых расстояниях, внутри атомного остатка, заряд ядра экранируется электронами заполненных оболочек не полностью, поэтому эффективный заряд больше единицы, причем тем больше, чем больше порядковый номер элемента Z. В случае кулоновского поля расщепление пропорционально
, т.е. определяется областью малых значений r; то же имеет место для щелочных элементов. Но на малых расстояниях, внутри атомного остатка, заряд ядра экранируется электронами заполненных оболочек не полностью, поэтому эффективный заряд больше единицы, причем тем больше, чем больше порядковый номер элемента Z. В случае кулоновского поля расщепление пропорционально  . Естественно предположить, что и в данном случае расщепление быстро возрастает с увеличением эффективного заряда.
. Естественно предположить, что и в данном случае расщепление быстро возрастает с увеличением эффективного заряда.
Зная тонкую структуру термов, нетрудно выяснить характер расщепления линий различных серий.
Правило отбора по j разрешает переходы  . Правило отбора по четности выполняется автоматически, так как в данном случае L совпадает с l и термы S, D четны, а термы P, F – нечетны. Учитывая это, получаем
. Правило отбора по четности выполняется автоматически, так как в данном случае L совпадает с l и термы S, D четны, а термы P, F – нечетны. Учитывая это, получаем
Главная серия – дуплеты  ,
,
Резкая серия – дуплеты  ,
,
Диффузная серия – триплеты 
Фундаментальная серия - триплеты .
.
При анализе экспериментальных данных надо учитывать следующее обстоятельство. Мультиплетное расщепление быстро убывает с увеличением n. У водорода зависимость мультиплетного расщепления от n,l определяется фактором 1/ . Для щелочных металлов эта формула непосредственно неприменима. Однако и в этом случае имеет место быстрое убывание мультиплетного расщепления с увеличением n,l. В качестве примера приведем значения дуплетного расщепления термов
. Для щелочных металлов эта формула непосредственно неприменима. Однако и в этом случае имеет место быстрое убывание мультиплетного расщепления с увеличением n,l. В качестве примера приведем значения дуплетного расщепления термов  Na. (таблица 3)
Na. (таблица 3)
 |
Таблица 3
 |
Дуплетное расщепление линии главной серии определяется тонкой структурой верхних термов
 , так как нижний терм является синглетным(рис.3).
, так как нижний терм является синглетным(рис.3). Рис.3
Поэтому дуплетное расщепление особенно велико для головных линий главной серии.
При переходе к высшим, более коротковолновым членам серии дуплетное расщепление быстро падает. У Li лишь резонансная и несколько следующих за ней линий имеют вид дуплетов. Для остальных линий расщепление не разрешается. У Na все наблюдаемые серии имеют дуплетную структуру. У Cs расщепление еще больше.
Дуплетное расщепление линий резкой серии, наоборот, полностью определяется тонкой структурой нижнего терма  (рис.3). Поэтому все линии резкой серии имеют в шкале частот или волновых чисел одинаковое дуплетное расщепление. В шкале длин волн расщепление растет как
(рис.3). Поэтому все линии резкой серии имеют в шкале частот или волновых чисел одинаковое дуплетное расщепление. В шкале длин волн расщепление растет как  , так как
, так как  .
.
Строение триплетов диффузной серии показано на рис.4.
 |
Рис.4
Расстояние между двумя компонентами триплета  определяется расщеплением нижнего терма и постоянно для всех линий диффузной серии. Расстояние между компонентами
определяется расщеплением нижнего терма и постоянно для всех линий диффузной серии. Расстояние между компонентами  , определяемое расщеплением термов
, определяемое расщеплением термов  , значительно меньше по величине и быстро убывает для высших членов серии. При небольшой разрешающей силе спектральной аппаратуры эти компоненты не разрешаются, поэтому линии диффузной серии имеют вид дуплетов. Аналогичным образом легко установить структуру линий фундаментальной серии.
, значительно меньше по величине и быстро убывает для высших членов серии. При небольшой разрешающей силе спектральной аппаратуры эти компоненты не разрешаются, поэтому линии диффузной серии имеют вид дуплетов. Аналогичным образом легко установить структуру линий фундаментальной серии.
В соответствии с сформулированным выше правилом отношение интенсивностей компонент дублета, берущих начало с уровней  и
и  (или оканчивающихся на уровнях
(или оканчивающихся на уровнях  ,
, ), равно (2
), равно (2 +1):(2
+1):(2 +1). Для дублетов главной и резкой серии это отношение равно 1:2.
+1). Для дублетов главной и резкой серии это отношение равно 1:2.
При сопоставлении теоретического отношения и интенсивностей с экспериментальным необходимо учитывать ряд факторов, связанных с условиями возбуждения и излучения.
4.Общая характеристика спектров щелочных металлов.
Потенциалы ионизации и резонансные потенциалы атомов щелочных металлов невелики. Поэтому атомы щелочных металлов легко возбуждаются даже в низкотемпературных источниках. Наиболее благоприятны условия возбуждения в пламени. В более высокотемпературных источниках – дуга, искра и т.д. концентрация нейтральных атомов очень мала, так как подавляющая часть щелочных атомов ионизуется. При температурах 5000-6000 К имеет место почти полная ионизация. Из таблицы 4 видно, что система термов занимает по шкале энергий всего примерно 2,5-3,5 эв. Вследствие этого основные спектральные серии расположены в видимой и инфракрасной областях спектра. В видимой части спектра находятся и резонансные линии.
5.Спектры меди, серебра и золота.
Атомы Cu, Ag и Au в основном состоянии также имеют вне заполненных оболочек один ns-электрон. Атому серебра в периодической системе предшествует атом ртути, оболочка 4d которого полностью заполнена. Поэтому у Ag сравнительно легко возбуждается только внешний 5s-электрон и спектр полностью подобен спектрам щелочных металлов. Для Cu и Au ситуация несколько иная. Атому Cu предшествует Ni с конфигурацией  , а не
, а не  . Аналогичным образом, перед Au стоит Pt с конфигурацией
. Аналогичным образом, перед Au стоит Pt с конфигурацией  .Это показывает, что у меди и золота энергии связи s- и d-электронов примерно одинаковы, поэтому наряду с возбуждением s-электрона возможно возбуждение d-электрона. Возбужденным состояниям s-электрона Cu и Au соответствуют системы термов того же типа, что и у щелочных металлов. При возбуждении d-электрона возможны новые состояния. Для Cu в общем случае -
.Это показывает, что у меди и золота энергии связи s- и d-электронов примерно одинаковы, поэтому наряду с возбуждением s-электрона возможно возбуждение d-электрона. Возбужденным состояниям s-электрона Cu и Au соответствуют системы термов того же типа, что и у щелочных металлов. При возбуждении d-электрона возможны новые состояния. Для Cu в общем случае -  .
.
В общем случае, таким образом, возможны системы дублетных и квартетных термов.
Границы ионизации щелочноподобных систем термов Cu и Au определяются энергией основных состояний ионов  и
и  .Если же ионизация происходит за счет одного из d-электронов, то ион
.Если же ионизация происходит за счет одного из d-электронов, то ион  оказывается в одном из состояний
оказывается в одном из состояний  . Поэтому термы, связанные с возбуждением d-электрона, сходятся к границам ионизации
. Поэтому термы, связанные с возбуждением d-электрона, сходятся к границам ионизации  и
и  . В случае Au также появляются новые границы ионизации
. В случае Au также появляются новые границы ионизации  .
.
Наличие дополнительных систем термов приводит к тому, что спектры Cu и Au значительно сложнее спектров щелочных элементов.














 (zip - application/zip)
(zip - application/zip)